
Évaluer les effets des polluants chimiques sur les êtres vivants et les écosystèmes : les grands principes
Élus en charge de l’écologie, industriels confrontés à l’impact toxique de leurs produits, associations et consommateurs inquiets par la pollution de l’air, de l’eau et des sols… Toutes ces personnes ont besoin de réponses précises quant à l’impact des substances chimiques sur l’environnement. Mais évaluer les effets des polluants sur les êtres vivants et les écosystèmes n’est pas aisé, et doit nécessairement associer des approches complémentaires regroupées au sein d’une « boîte à outils », dans laquelle l’écotoxicologie a toute sa place.
I. ÉVALUER LES EFFETS DES POLLUANTS POUR PROTÉGER LE MILIEU NATUREL
1. L’ensemble des milieux naturels sont contaminés par des polluants chimiques
Fumées des usines et des véhicules, eaux usées des collectivités et des installations industrielles, rejets issus de l’agriculture intensive, activités minières… chaque jour, les activités humaines dispersent une grande variété de substances chimiques dans les milieux naturels.
Par rejet direct, ruissellement ou infiltration, ces substances et leurs dérivés se retrouvent pour bonne part dans les milieux aquatiques. En France, des études à grande échelle ont notamment révélé la présence de pesticides dans 91 % des points suivis en cours d’eau (Onema, 2013). Des phtalates et des parabènes, substances utilisées dans des produits de grande consommation, ont également été retrouvés dans 95 % des eaux de surfaces et souterraines échantillonnées (INERIS, 2014).

Le milieu terrestre n’est malheureusement pas épargné. L’Agence Européenne de l’Environnement estime par exemple à près de 250 000 le nombre d’anciens sites industriels dont le sol est contaminé, le plus souvent en métaux ou en hydrocarbures (CGDD, 2013). Concernant la pollution par les microplastiques, actuellement très médiatisée, une étude suisse a révélé que la quantité de plastiques libérée sur et dans les sols serait près de 40 fois plus élevée que celle qui se disperse dans les eaux : l’agriculture et le secteur de la construction en représentent les sources les plus importantes (ADEME, 2019b).
Enfin, il est bien connu que l’atmosphère peut également être chargée de nombreux polluants, tels que les oxydes d’azote (responsables des pluies acides), l’ozone, l’ammoniac, les métaux lourds ou les gaz à effet de serre (CO2, CH4 et NO2). Ce qui l’est moins, c’est qu’elle contient elle aussi de minuscules fragments de plastiques. Des chercheurs ont récemment modélisé l’air au-dessus de l’ouest des États-Unis et ont découvert qu’il contenait près de 1 000 tonnes de microplastiques, la plupart provenant de l’usure des pneus de voiture (Brahney, 2020).
2. Des impacts environnementaux très variables selon les polluants
La pollution de l’eau, des sols et de l’air fait partie des causes majeures d’atteinte à la biodiversité (Ministère de l’Environnement, 2021). Mais tous les polluants ne se valent pas : alors que certains n’ont pas ou peu d’effet sur les organismes vivants, même à des concentrations élevées, d’autres désignés sous le terme de micropolluants peuvent être toxiques même à de très faibles concentrations, de l’ordre du µg/L ou du ng/L.
Quelques repères
1 microgramme est 1 000 000 fois plus léger qu’1 gramme
1 nanogramme est 1 000 fois plus léger qu’1 microgramme-1 morceau de sucre dans un bassin olympique = 1 µg/L
1 petit grain de sable = 3 µg
1 grain de sel dans un bassin olympique = 1 ng/L
La présence de ces micropolluants dans le milieu naturel peut entrainer des conséquences délétères sur les écosystèmes et affecter nos ressources, induisant un risque pour la santé humaine (Onema, 2013). En voici deux illustrations :
- en France, une étude portant sur 88 micropolluants organiques rejetés par les stations d’épuration (résidus de médicaments, pesticides, PCB, HAP, etc.) a révélé que ceux-ci pouvaient entrainer la disparition d’une espèce tous les 10 ans (Synteau, 2020) ;
- à l’échelle européenne, les observations montrent que les pesticides sont les principaux responsables de la perte de plus de 400 millions d’oiseaux en trente ans (Franceculture.fr, 2019).

D’autres substances chimiques ne sont pas toxiques par nature, mais peuvent modifier l’équilibre d’un milieu et ainsi porter atteinte aux espèces qui y vivent. C’est le cas des nitrates, qui, lorsqu’ils rejetés en grande quantité dans un lac ou un petit cours d’eau via des épandages agricoles ou des rejets de stations d’épuration, peuvent entrainer une prolifération des algues et par suite une asphyxie du milieu (procédé d’eutrophisation/dystrophisation).
3. Pourquoi mesurer les effets des polluants ?
Évaluer les effets des polluants sur les organismes vivants et les écosystèmes est un défi scientifique complexe. Cette évaluation est pourtant nécessaire (Vasseur, 2021) :
- pour anticiper les risques induits par les substances chimiques : cette évaluation a priori est notamment réalisée avant la mise sur le marché d’un pesticide (règlement CE n°1107/2009), d’un médicament ou d’un désinfectant (règlement européen Biocide) ainsi que dans le cadre du règlement européen REACH ;
- pour identifier les sources polluantes et mesurer leur impact sur l’environnement : cette évaluation a posteriori s’applique par exemple via la Directive européenne Cadre sur l’Eau (DCE) qui impose la surveillance, l’évaluation et la réduction de la contamination chimique des eaux continentales ; elle doit notamment permettre d’identifier les substances les plus préoccupantes afin d’œuvrer à leur encadrement et à l’atténuation de leurs impacts (Onema, 2013).
Cette évaluation des effets environnementaux des polluants fait appel à des outils développés dans les domaines de la chimie, de l’écologie et de l’écotoxicologie, chacune de ces approches ayant des avantages et des limites.
II. ANALYSES CHIMIQUES : INTÉRÊTS ET LIMITES
1. Des progrès très importants au cours des dernières années
Une analyse chimique permet de révéler la présence d’un ou plusieurs composé(s) dans un échantillon et, le plus souvent, d’en mesurer la concentration (ex : 0,2 µg/L d’un pesticide dans un échantillon d’eau de rivière). Les progrès réalisés au cours des dernières décennies dans les appareils analytiques, dans les techniques d’extraction* et dans le traitement des données permettent désormais :
- de détecter et de quantifier des substances chimiques présentes à l’état de traces (µg/L, ng/L, voire inférieur), qui étaient auparavant « invisibles » en raison de limites de détection trop élevées ;
- d’analyser des « matrices » de natures variées : de l’eau, du sol, de l’air, mais aussi des organismes vivants (vers de terre, poissons, plantes, etc.), des excréments, des sédiments, etc.

Composé détecté ou quantifié : de quoi parle-t-on ?
Les méthodes d’analyses sont spécifiques d’un composé ou d’une famille de composés. Chacune de ces méthodes est caractérisée par :
–une limite de détection (LD) : c’est la concentration minimale à partir de laquelle la méthode peut détecter le composé recherché. Exemple : si un pesticide est présent dans un échantillon d’eau à une concentration de 0,5 µg/L et que la LD de la méthode est de 1 µg/L, alors, l’analyse ne pourra pas détecter le composé (alors qu’il est bien présent) ;
–une limite de quantification (LQ) : c’est la concentration minimale à partir de laquelle la méthode peut « quantifier » le composé recherché, c’est à indiquer une valeur de concentration. Reprenons l’exemple précédent : si le pesticide est présent dans un échantillon à une concentration de 1,5 µg/L et que la LQ est de 2 µg/L, alors l’analyse pourra détecter le composé (car LD = 1 µg/L), mais ne pourra pas le quantifier (on ne connaîtra pas sa concentration précise).
Tout l’enjeu pour les laboratoires est donc de développer des méthodes ayant les LD et LQ les plus basses possibles, afin que de nombreuses substances chimiques présentes dans le milieu naturel ne passent pas “entre les mailles du filet”.
*Pour analyser une molécule il faut au préalable l’extraire de l’échantillon.
2. Mais on ne trouve que ce que l’on cherche
Plus de 100 000 substances chimiques sont ou ont été produites de manière industrielle à l’échelle mondiale (Onema, 2013). Chacune de ces substances, ainsi que ses produits de transformation (métabolites), peut donc potentiellement être présente dans l’environnement en plus en moins grande quantité.
Or, malgré les progrès de la chimie, il n’existe à ce jour aucune méthode permettant de détecter et d’identifier l’ensemble des substances contenues dans un échantillon en une seule analyse. Une surveillance de la qualité des milieux via des analyses chimiques implique donc de faire des choix. Prenons l’exemple des rivières. En France, leur « bon état chimique » est évalué via la mesure de 53 substances* (métaux, pesticides, hydrocarbures et autres polluants organiques industriels) (Agence de l’Eau SN, 2015). La très grande majorité des polluants ne sont donc pas recherchés dans ces eaux, alors même qu’ils contribuent au risque environnemental. C’est le cas par exemple des résidus de médicaments, dont on sait pourtant qu’ils peuvent avoir des effets à long terme sur les organismes vivants.
Les potentialités du screening non ciblé
Le screening ciblé, approche classique de la chimie analytique, permet de rechercher spécifiquement des substances déjà connues (exemple : une liste de 10 pesticides). A l’inverse, le screening non ciblé, dont le développement est très récent, permet ; en une seule analyse, d’identifier dans un échantillon un grand nombre de substances préalablement inconnues (possiblement plusieurs centaines voire plusieurs milliers de molécules). Très prometteuse, cette approche n’est pas encore déclinée dans les programmes de surveillance des milieux (OFEV, 2013).
*La DCE (Directrice Cadre sur l’Eau) impose la surveillance de 21 « substances prioritaires » et de 24 « substances dangereuses prioritaires », auxquelles il faut ajouter 8 substances issues de la liste I de la directive substances dangereuses 76/464 (Agence de l’Eau SN, 2015).
3. Et on ne mesure pas les effets sur le vivant
Les analyses chimiques ne permettent pas de mesurer les effets des substances sur les organismes vivants. Or, une même valeur de concentration (ex : 1 µg/Litre d’eau) peut être « sans effet pour l’environnement » pour une substance donnée (ex. : le paracétamol) mais très toxique pour une autre substance (ex. : le méthylisothiazolinone – MIT, molécule utilisée comme biocide et conservateur dans les peintures, produits de soin, etc.) (Conférence Eau et Santé 2019).

Il existe bien des seuils de concentrations à ne pas dépasser, établis par la communauté scientifique à partir de bioessais d’écotoxicologie (voir plus loin), mais ces seuils ne prennent pas en compte :
- les effets des mélanges de contaminants : dans le milieu naturel, un polluant n’est jamais seul ; les effets des substances peuvent s’annuler (antagonisme), s’ajouter ou se multiplier (on parle de synergie ou d’effet cocktail) ;
- les facteurs biotiques : présence de prédateurs, d’espèces concurrentes, de ressources en nourriture, etc.
- les facteurs abiotiques : lumière, température, composition du milieu, présence d’un barrage (si rivière), etc.
De ce fait, une même substance (ex : un pesticide), présente à une même concentration (ex : 1 µg/gramme de sol) peut s’avérer non toxique dans un milieu et toxique dans un autre, vis-à-vis d’une même espèce (ex : un vers de terre).
4. Synthèse des avantages et des limites des analyses chimiques
| AVANTAGES | LIMITES |
| Permettent de détecter ou d’identifier une substance dans un échantillon, même lorsqu’elle n’est présente qu’à l’état de traces | Une analyse est limitée à une liste (réduite ou étendue) de substances |
| Permettent de quantifier la substance recherchée (détermination d’une concentration ou d’un flux) | Ne permettent pas de connaître les effets d’une substance sur les organismes vivants |
| Le screening non ciblé permet de détecter/identifier un grand nombre de substances en une seule analyse | Ne prennent pas en compte les effets des mélanges de contaminants, ni les facteurs biotiques et abiotiques |
| S’appliquent à une grande diversité d’échantillons : eau, sol, air, organisme, etc. | |
| Les résultats d’analyses peuvent être comparés à des seuils (réglementation) | |
| Si le polluant est spécifique, possibilité de remonter à la source de la pollution |
III. LA BIOSURVEILLANCE : UTILISER LE VIVANT POUR ÉVALUER L’ÉTAT D’UN MILIEU NATUREL
1. Biosurveillance (ou biomonitoring) : de quoi parle-t-on ?
Intéressons-nous à la problématique spécifique de l’évaluation de l’état d’un milieu. Nous avons vu que les analyses physico-chimiques étaient utiles mais insuffisantes pour évaluer le risque environnemental lié aux polluants. Pour mesurer les effets de substances sur des organismes vivants, il est donc nécessaire d’utiliser… le vivant.
Cette approche, qui a émergé à partir des années 1980 est appelée biosurveillance. Elle désigne l’ensemble des outils basés sur « l’utilisation du vivant (organisme ou ensemble d’organismes à tous les niveaux d’organisation biologique moléculaire, biochimique, cellulaire, physiologique, tissulaire, morphologique et écologique) pour surveiller l’évolution des modifications et des altérations, ou la stabilité de la qualité d’un milieu » (PIREN-Seine, 2011). La vidéo ci-dessous, éditée par l’agence de l’eau Adour-Garonne, vous donnera un bon aperçu de ce qu’est la biosurveillance et de ce qu’elle peut apporter pour la surveillance de la contamination chimique des milieux.
2. Plusieurs niveaux d’observation possibles
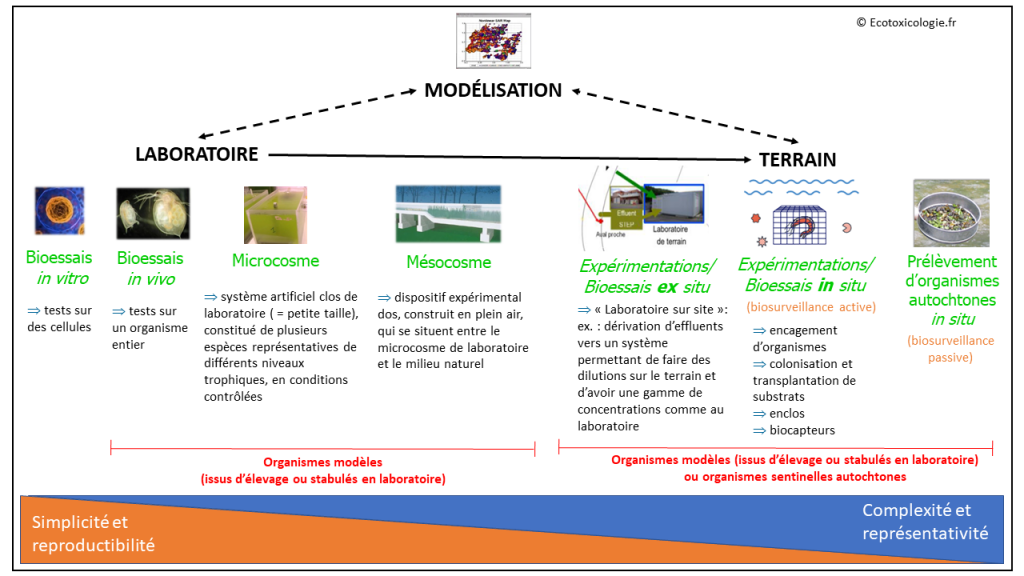
La biosurveillance peut s’appliquer à différentes échelles, comme illustré dans le schéma ci-après.
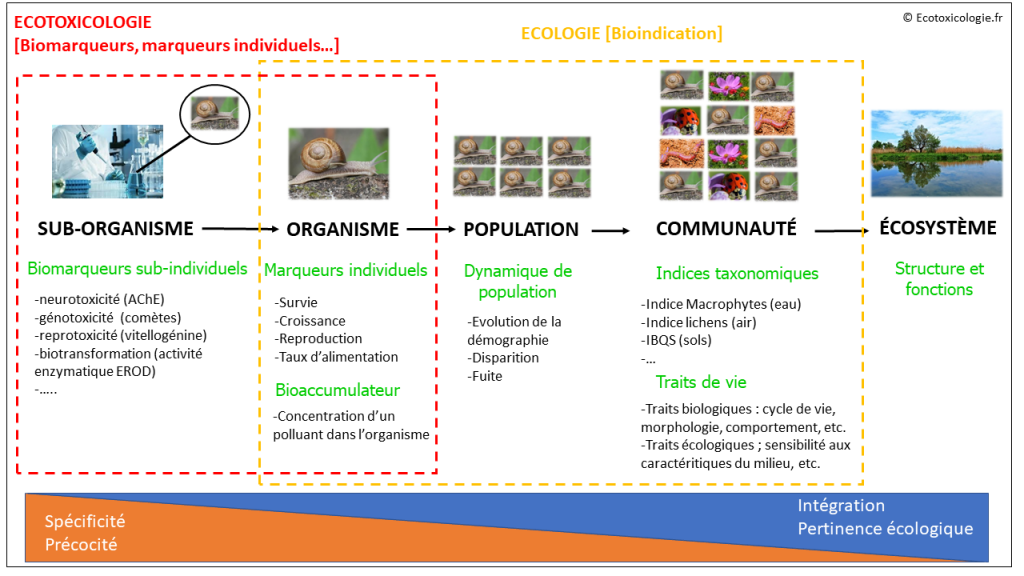
3. La bioindication pour une évaluation de l’état écologique global d’un milieu [ÉCOLOGIE]
3.1 Qu’est-ce qu’un bioindicateur ?
La bioindication s’intéresse préférentiellement aux échelles supra-individuelles, c’est-à-dire aux populations (organismes d’une même espèce) et aux communautés (assemblage d’organismes de plusieurs espèces) (Cemagref, 2010). Elle fait appel à des bioindicateurs, espèces ou groupe d’espèces dont les caractéristiques observées (occurrence, abondance, biomasse, comportement, « traits de vie », etc.) fournissent une indication sur le niveau de dégradation d’un milieu (Onema, 2012). Les scientifiques désignent parfois ces espèces bioindicatrices sous le terme d’ espèces sentinelles (PIREN-Seine, 2011).
Les bioindicateurs visent à une évaluation écologique globale des écosystèmes. Bien que n’étant pas évacuée de leur champ d’action, l’évaluation du risque lié aux polluants « toxiques » n’est pas leur objectif premier (contrairement aux biomarqueurs) (Cemagref, 2010). En effet, les espèces bioindicatrices sont sélectionnées pour leur sensibilité :
- à la dégradation de la qualité de l’eau, de l’air ou du sol : présence de polluants de toutes natures, eutrophisation (pour les milieux aquatiques), hausse de température, etc. ;
- mais aussi à d’autres perturbations d’origine anthropique : altérations du fonctionnement hydromorphologique d’un cours d’eau (par exemple liées à un barrage), fragmentation des habitats naturels, etc.
Le choix d’une espèce sentinelle dépend également d’autres critères tels que la sédentarité, l’aire de répartition (qui doit être la plus large possible), la facilité d’identification et de capture, la longévité et la biologie de l’espèce (PIREN-Seine, 2011). Parmi les plus utilisées, on peut citer le gammare (petit crustacé d’eau douce), la moule (eau de mer), le lichen (air) et diverses espèces de vers de terre (sol).

3.2 La bioindication basée sur des descripteurs taxonomiques
Les scientifiques distinguent classiquement deux approches de bioindication. La première est basée sur des descripteurs taxonomiques. Elle consiste à décrire l’état de santé d’un milieu à partir :
- de la richesse taxonomique : nombre total de taxons (espèces/genres/familles) identifiés sur un site d’étude ;
- de la diversité des espèces présentes : indices de diversité calculés en fonction du nombre d’espèces et de la répartition des individus au sein de ces espèces ;
- des abondances relatives de chaque taxon ;
- ou encore la présence/absence d’espèces indicatrices (sentinelles).
Cette approche taxonomique est la forme de bioindication la plus couramment utilisée (Cemagref, 2010). Dans le domaine des milieux aquatiques par exemple, la Directive Cadre sur l’Eau (DCE) impose l’utilisation d’indices biologiques comme l’IBD (Indice biologique Diatomées) ou l’IBMR (Indice biologique Macrophytes en Rivière), qui permettent, à partir de la structure des communautés autochtones, de donner une note de qualité et de contribuer à définir l’état écologique d’un cours d’eau.
Pour mieux comprendre le principe de ces indices, intéressons-nous plus particulièrement aux diatomées (Vasselon, 2019). Ces dernières sont des algues unicellulaires microscopiques, présentes dans toutes les eaux du globe. Elles vivent notamment sur ce que les scientifiques nomment le périphyton, la pellicule glissante présente sur les cailloux des cours d’eau, composée d’algues, de champignons et de bactéries vivant en symbiose. Il existe des centaines de milliers d’espèces de diatomées, chacune caractérisée :
- par des préférences écologiques spécifiques : intensité de lumière, niveau de turbulence de l’eau, quantité de nutriments, etc.;
- et par un niveau de sensibilité aux pollutions : peu tolérante, moyennement tolérante, très tolérante…
Il est donc possible de calculer un indice de qualité de l’eau d’un site (une note /20) en prélevant un échantillon de périphyton et en identifiant les espèces de diatomées présentes, comme illustré ci-dessous.
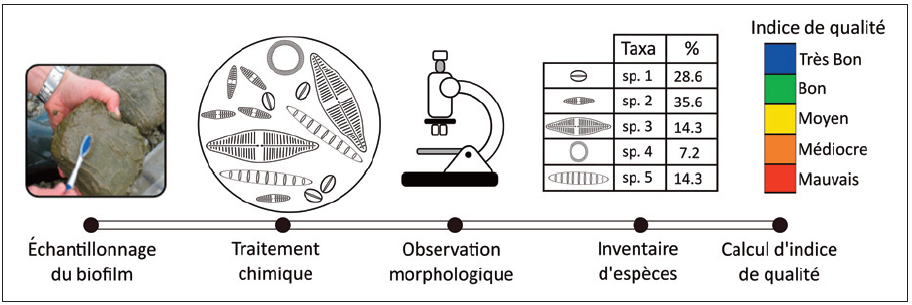
Les indices taxonomiques sont de bons indicateurs de la qualité d’un milieu. Ils présentent néanmoins plusieurs limites importantes (Cemagref, 2010) :
- ils reflètent difficilement la variabilité naturelle des communautés selon les zones géographiques ;
- ils ne permettent pas d’établir un diagnostic précis sur l’origine de la dégradation d’un milieu ;
- ils discriminent rarement les impacts des perturbations anthropiques des fluctuations naturelles (temporelles et/ou spatiales).
3.3 La bioindication basée sur des traits de vie
La seconde approche de la bioindication, basée sur des descripteurs non taxonomiques, permet de révéler des informations complémentaires. Celle-ci consiste à étudier les « traits de vie » (ou « traits d’histoire de vie ») des espèces présentes dans un milieu. Ces traits de vie rassemblent l’ensemble des informations quantitatives et qualitatives associées à la biologie des organismes et à leurs relations avec l’environnement. Ils peuvent être divisés en deux catégories :
- les traits biologiques : cycle de vie, potentialités de résistance ou de résilience, morphologie, physiologie ou comportement d’un taxon ;
- les traits écologiques : variables caractérisant les affinités (sensibilité/tolérance) et préférences d’un taxon pour certaines caractéristiques d’un habitat (distribution spatiale, paramètres physico-chimiques du milieu, présence de nutriments, etc.)
En appliquant ce principe de bioindication basée sur les traits de vie, les chercheurs développent différents outils de diagnostic. Ceux-ci permettent de calculer, d’après les fréquences d’apparition de certains traits biologiques ou écologiques au sein des communautés autochtones, les probabilités qu’un milieu donné soit affecté par différents types de pressions : présence de matières phosphorées, micropolluants minéraux, pesticides, urbanisation, instabilité hydrologique, etc.
3.4 Synthèse des avantages et des limites de la bioindication
| AVANTAGES | LIMITES |
| Permet une évaluation de l’état écologique global d’un milieu | Moins précoce que les biomarqueurs pour détecter les impact des polluants « toxiques » |
| La bioindication basée sur les traits de vie permet de distinguer l’impact de différents types de pression | La bioindication basée sur les descripteurs taxonomiques ne permet pas de distinguer de façon fine l’effet des différents types de perturbation |
| Les indices taxonomiques sont largement utilisés depuis des dizaines d’années : recul et données de comparaison disponibles | En cas de pollution « toxique », la bioindication ne permet pas d’identifier la ou les substances responsable(s) : difficulté à établir des plans de réduction des contaminants |
| De nombreux protocoles normalisés, des seuils consensuels, etc. | Ne permet pas de mesurer la variabilité de réponses entre individus |
Et la « biointégration » ?
Selon les domaines de recherche, les mots n’ont pas toujours le même sens. Ainsi, dans le domaine de la biosurveillance de l’air (Atmo Grand Est, 2019) :
-la bioindication est définie comme « l’observation d’altérations visibles (physiologiques, morphologiques ou tissulaires) d’un organisme à une pollution » : l’échelle d’observation n’est donc pas la population et la communauté, comme dans la définition de la bioindication citée plus haut (définition issue du domaine de l’eau)
-un autre terme apparait : la biointégration, qui correspond « à l’étude des modifications des coefficients de présence, d’absence et d’abondance des espèces au sein de populations ou de communautés »
Enfin, selon les publications, l’utilisation d’organismes bioaccumulateurs (bioaccumulation) peut être considérée comme une approche intégrée dans la bioindication, ou bien comme une approche à part.
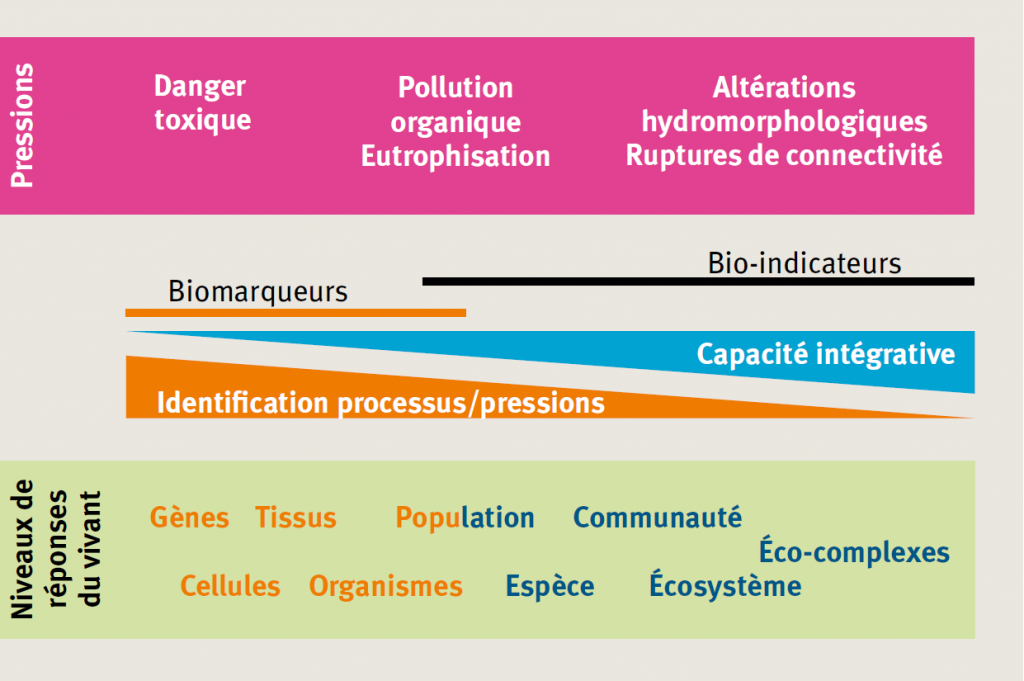
4. Les biomarqueurs pour l’évaluation du risque toxique [ÉCOTOXICOLOGIE]
4.1 Qu’est-ce qu’un biomarqueur ?
Tout organisme exposé à une pollution chimique met en œuvre une diversité de réponses moléculaires et cellulaires qui lui permettent de faire face à l’agression par les polluants (INERIS, 2008). L’approche par biomarqueurs consiste à étudier ces réponses biologiques sur des organismes de laboratoire, des organismes autochtones ou des organismes encagés dans le milieu naturel, afin d’établir le diagnostic d’une pollution. A l’inverse des bioindicateurs, les biomarqueurs sont donc spécifiquement conçus pour évaluer le risque lié à des polluants toxiques (= risque écotoxicologique ou écotoxique).
Du fait de la variabilité des réponses biologiques entre espèces, les biomarqueurs sont évalués sur des organismes sentinelles pour lesquels un travail préalable de développement/validation de la mesure a été réalisé (PIREN-Seine, 2011).
4.2 Des indicateurs précoces, sensibles et spécifiques…
Les biomarqueurs sont réputés comme des indicateurs précoces. Tels une « sonnette d’alarme », ils peuvent permettre de détecter une pollution avant que les effets dommageables pour les populations et communautés ne soient à l’œuvre.
Ils présentent également l’avantage d’être sensibles et spécifiques. En effet, les réponses d’un organisme à une pollution sont basées sur des mécanismes qui peuvent être spécifiques de familles de composés chimiques et/ou d’un mode d’action toxique (INERIS, 2009). La mesure d’un biomarqueur peut donc s’avérer précieuse pour identifier les mécanismes à l’origine des effets de contaminants et pour orienter le diagnostic d’une pollution.
Pour ces raisons et parce qu’ils sont parfaitement complémentaires des analyses chimiques et écologiques, les biomarqueurs sont largement utilisés dans le milieu de la recherche.

4.3 … mais encore peu utilisés en routine
En revanche, leur utilisation dans les programmes réglementaires de surveillance des milieux est à ce jour beaucoup plus sporadique, du fait de plusieurs problèmes méthodologiques,
En effet, un gestionnaire de milieu naturel qui souhaiterait utiliser ces outils ne dispose généralement pas de méthodologie éprouvée permettant de sélectionner le mode d’échantillonnage, le ou les biomarqueur(s) le(s) plus pertinent(s) et l’espèce sentinelle associée (Cemagref, 2010) . Certains écotoxicologues soulignent également la difficulté d’interprétation des données, et plus particulièrement la problématique de la définition de valeurs de référence auxquelles comparer les résultats de mesures de biomarqueurs. En effet, de nombreux facteurs individuels et environnementaux (état physiologique, âge, température, du milieu, antécédent d’exposition, habitat, etc.) influencent les paramètres étudiés, rendant la définition de valeurs de référence absolues particulièrement complexe (Sanchez, 2012).
Grâce aux efforts des chercheurs et aux processus de normalisation, ces limites sont néanmoins en train de s’estomper. On peut citer l’exemple du projet B&B (Biomarqueurs et Biodiversité) qui a permis d’aboutir en 2021, au 1er outil national de sélection des couples espèce-biomarqueur pour le suivi de la qualité des masses d’eau. Grâce à ces travaux, les biomarqueurs sont amenés à prendre peu à peu leur place dans les programmes de surveillance.
4.4 Catégories et exemples de biomarqueurs
Les biomarqueurs peuvent être mesurés à trois échelles (Cemagref, 2010) :
- l’échelle moléculaire et cellulaire : pour une réponse sensible et rapide (alarme) ;
- l’échelle tissulaire : pour une évaluation des dommages aux organes (histologie) ;
- l’échelle de l’organisme entier : pour une évaluation du potentiel de survie, des performances de reproduction, etc. On désigne parfois ces indicateurs sous le terme de « marqueurs individuels ».
On distingue classiquement deux grandes catégories de biomarqueurs (PIREN-Seine, 2011 ; Moreau, 2010 ; Onema, 2013). Les biomarqueurs d’exposition (1ère catégorie, également appelés biomarqueurs de présence) signent l’activation de mécanismes de régulation, d’adaptation et de défense face à un polluant. Ils indiquent si le polluant a pénétré dans l’organisme et sont particulièrement utiles si les contaminants sont instables et difficiles à rechercher par analyse chimique.
L’activité enzymatique EROD est, chez certains poissons notamment, un bon exemple de biomarqueur d’exposition aux HAP, PCB et dioxines. Celle-ci se déclenche lors de la biotransformation des contaminants par l’organisme, mise en œuvre pour les « détoxifier ». Une activité EROD élevée peut donc être le signe d’une pénétration de ces polluants dans les poissons, comme illustré dans l’exemple des gardons de la Seine ci-dessous.
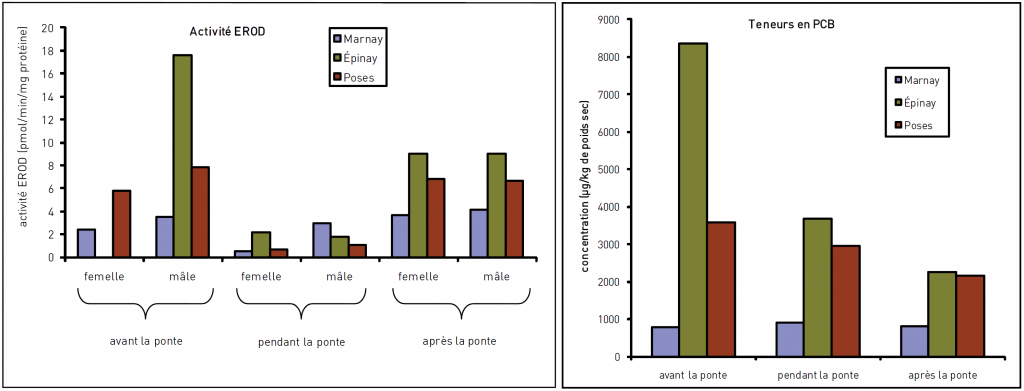
Les biomarqueurs d’effet (2ème catégorie) diagnostiquent un dépassement des capacités de régulation de l’organisme et constituent un signal d’alerte d’apparition de perturbations du fonctionnement de l’organisme, voire de sa population : ils traduisent les conséquences physio-pathologiques de l’exposition à un polluant. Parmi ces biomarqueurs d’effet, on peut citer :
- l’acétylcholinestérase (AChE), enzyme impliquée dans la transmission de l’influx nerveux, qui renseigne sur les effets neurotoxiques (= toxiques pour le système nerveux) d’une pollution. Ce biomarqueur est par exemple utilisé sur les gammares (crevettes d’eau douce) et les abeilles (notamment pour des études portant sur les effets des néonicotinoïdes) (Samson-Robert, 2014).
- le taux de cassure des brins d’ADN (essai des comètes), révélateur des effets génotoxiques de contaminants : l’exemple ci-dessous est une illustration de résultats obtenus à partir de ce biomarqueur mesuré sur des cellules immunitaires de moules d’eau douce (dreissènes).
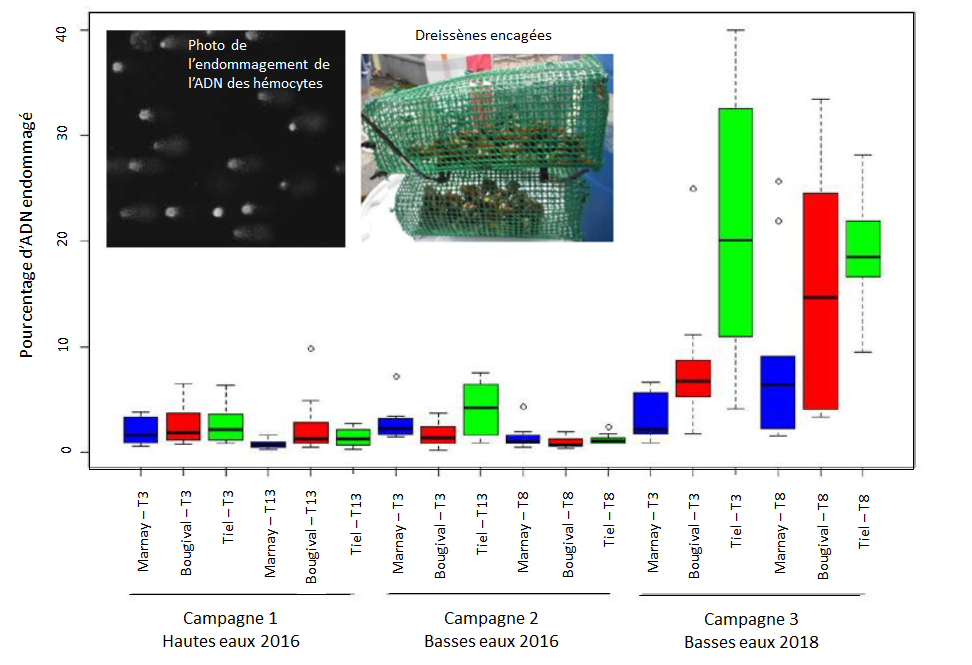
A noter que la plupart des études intégrant des biomarqueurs dans un objectif de surveillance ou d’évaluation d’un milieu associent une batterie de biomarqueurs, qui apportent des informations complémentaires en termes de substances prises en compte, d’effets mesurés et de niveaux biologiques (Cemagref, 2010).
4.5 Synthèse des avantages et des limites des biomarqueurs
| AVANTAGES | LIMITES |
| Permettent une évaluation du risque toxique induit par des polluants | Ne permettent pas d’évaluer l’état écologique global d’un milieu |
| Indicateurs précoces d’une pollution (alarme) | Il est souvent nécessaire de mettre en œuvre une batterie de biomarqueurs afin de disposer des informations suffisantes au diagnostic |
| Peuvent conserver la trace d’une pollution passée | Ne permettent pas à eux seuls d’identifier une molécule responsable des effets observés |
| Indicateurs spécifiques d’une famille de substances chimiques et/ou d’un mode d’action toxique | Pas souvent de méthodologie standardisée disponible pour choisir le(s) biomarqueur(s), l’espèce sentinelle et le type d’échantillonnage adaptés |
| Indicateurs sensibles (réagissent à de très faibles concentrations de contaminants) | Un travail préalable de développement/validation de la mesure doit être réalisé par les scientifiques pour chaque couple « biomarqueur/espèce » |
| Permettent de décrire les mécanismes toxicologiques en jeu | Il est difficile d’établir des valeurs de référence absolues car les paramètres étudiés sont dépendants de nombreux facteurs individuels et environnementaux |
| Tiennent compte des interactions entre contaminants (effets additifs, synergiques ou antagonistes) | Le manque de connaissances sur la biochimie, la physiologie et le comportement de certains organismes sentinelles limite encore l’utilisation optimale de ces outils |
| Les biomarqueurs d’exposition renseignent sur la fraction biodisponible du ou des contaminant(s) | |
| Les biomarqueurs d’effets renseignent sur les effets induits par les polluants (fraction active des contaminants) |
IV. LABORATOIRE, TERRAIN, MODÉLISATION : DES APPROCHES COMPLÉMENTAIRES EN ÉCOTOXICOLOGIE
On distingue classiquement trois grandes approches en écotoxicologie : les expérimentations de laboratoire, le terrain et la modélisation. Le mésocosme est généralement considéré comme l’intermédiaire entre le laboratoire et le terrain.
1. Les bioessais de laboratoire
1.1 Qu’est-ce qu’un bioessai de laboratoire ?
Pour des raisons pratiques, l’écotoxicologie s’est d’abord centrée sur l’étude de l’effet des polluants sur les organismes via des bioessais réalisés en laboratoire, avec une démarche proche de la toxicologie (Pery, 2009).
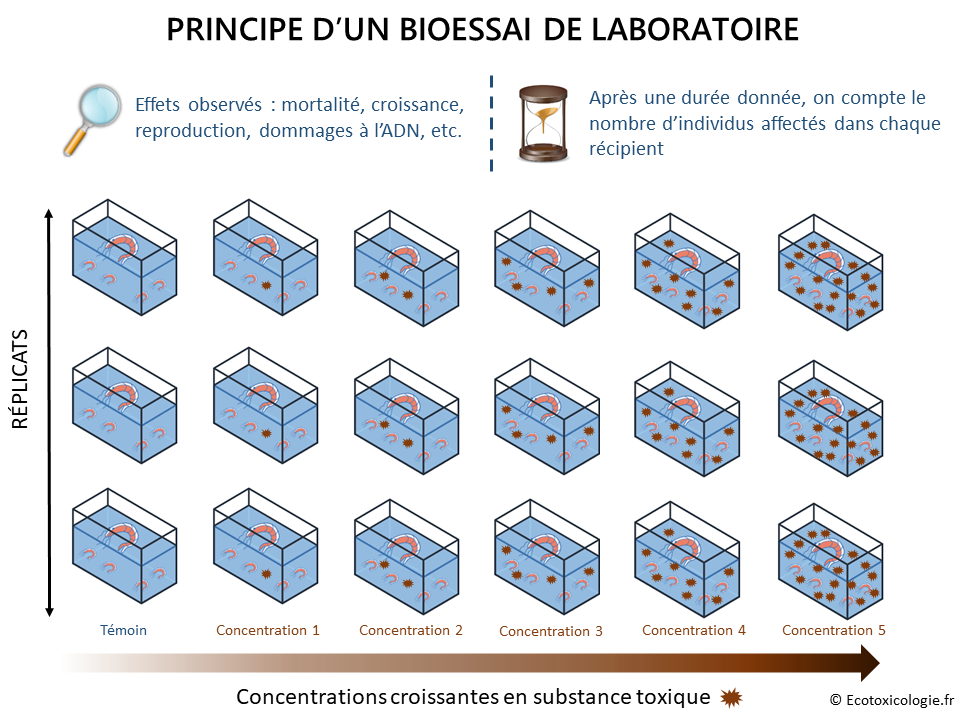
Ces bioessais, également appelés biotests ou tests de toxicité en laboratoire, consistent à exposer un modèle vivant (cellules, organismes ou communautés d’organismes) à une substance (ex. : un pesticide), à un mélange de substances (ex. : plusieurs pesticides) ou à un échantillon environnemental (ex. : eau de rivière, sol, air, effluent industriel, etc.), dans un milieu ( = un récipient comme un aquarium, une microplaque, un pot, etc.), en conditions contrôlées (température, taux d’oxygène, salinité, nourriture, lumière, etc.), pendant une durée déterminée, et à observer un ou plusieurs effet(s) de cette substance sur le modèle vivant étudié tels que la mortalité, la croissance, la reproduction ou les dommages à l’ADN : on parle de « critère(s) d’évaluation » ou « endpoint(s) ».
Comme l’illustre le schéma ci-dessous, le modèle vivant est exposé à différentes concentrations de la substance ou de l’échantillon environnemental étudié. Un témoin négatif (sans substance toxique) est également nécessaire pour valider les résultats du bioessai et établir les valeurs de référence (voir plus loin). Plusieurs réplicats de chacune des concentrations testées sont requis pour garantir la précision et la fiabilité des résultats.
Toxicité aigüe VS toxicité chronique
Selon la durée d’exposition, on distingue les bioessais de toxicité aigüe (exposition à une forte dose ou à une substance très toxique pendant un temps court) et les bioessais de toxicité chronique (exposition à une faible dose pendant un temps long). A noter que cette notion de temps court ou long est relative à la durée de vie de l’organisme modèle : dans le cas d’un bioessai de toxicité chronique, le temps d’exposition correspond en moyenne à 10 % de la vie de l’organisme et doit intégrer plusieurs stades de son cycle de vie (Angerville, 2009).
1.2 Les différents types de bioessais de laboratoire
Il existe une multitude de bioessais de laboratoire, pouvant être catégorisés selon différents critères :
| CRITÈRE | CATÉGORIES DE BIOESSAIS | EXEMPLES DE BIOESSAIS DE LABORATOIRE |
| Normalisation | Bioessais normalisés | -Essai d’inhibition de la mobilité de Daphnia magna (ISO 6341, OCDE 202) -Test d’Ames (ISO 16240) |
| Bioessais non normalisés | -De nombreux bioessais expérimentaux appliqués dans des laboratoires de recherche (ex. : essai non normalisé sur la reproduction d’un mollusque d’eau douce) | |
| Nature du modèle vivant | Bioessais in vitro (modèle cellulaire) | -Le test YES (cellules de levure de boulanger Saccharomyces cerevisiae génétiquement modifiées) -Le test ER-Calux (cellules humaines) |
| Bioessais in vivo ou in toto (organisme entier) | -Essais de toxicité sur crustacés (Daphnia magna), algues vertes (Raphidocelis subcapicata) ou vers de terre (Eisenia fetida) ou bactérie (Vibrio fischeri) | |
| Microcosmes (« bioessais plurispécifiques ») | -Aquarium contenant des organismes de différents niveaux trophiques (ex : algues, microcrustacés et poissons) | |
| Compartiment de vie de l’organisme modèle | Aquatique | -Essai de survie du poisson zèbre (Danio rerio) |
| Terrestre | -Essai sur la germination et les premiers stades de croissance des végétaux supérieurs -Essai de toxicité chronique sur les abeilles domestiques par voie orale | |
| Durée d’exposition | Bioessais de toxicité aigüe (temps « court ») | -Essai d’inhibition de la mobilité de Daphnia magna (24h ou 48 h) -Essai d’évitement des vers de terre Eisenia fetida (48 h) |
| Bioessais de toxicité chronique (temps « long ») | -Essai de reproduction de Daphnia magna Strauss (21 jours) -Essai de reproduction des vers de terre Eisenia fetida (8 semaines) | |
| Type d’effet étudié (qui dépend en partie de la durée et de la dose d’exposition) | Létalité (mort) ou grave trouble physiologique | -Essai d’inhibition de la mobilité de Daphnia magna |
| Effet reprotoxique (perturbation de la reproduction ou effets sur la descendance) | -Essai de reproduction des vers de terre Eisenia fetida | |
| Effet génotoxique ou mutagène (dommages à l’ADN) | -Test des comètes | |
| Perturbation endocrinienne | -Test YES | |
| … | … |

1.3 L’établissement de valeurs de référence
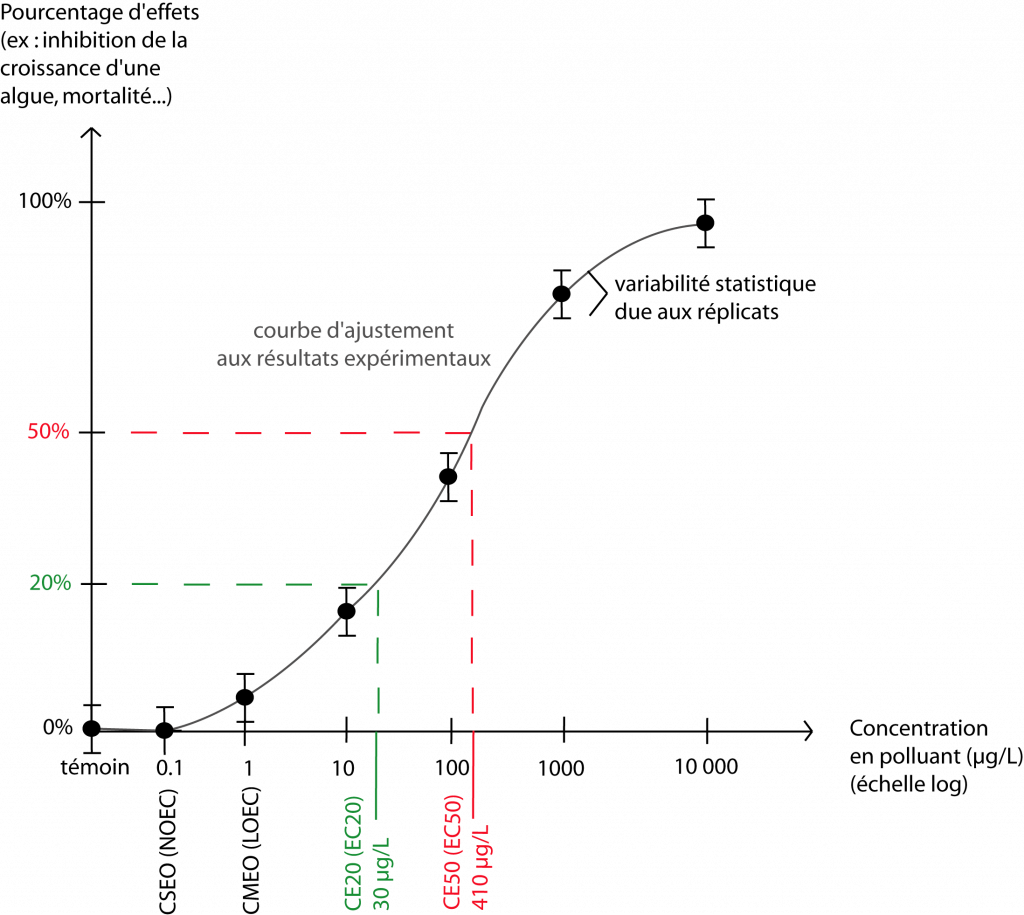
Les résultats de ces bioessais permettent d’établir des valeurs de référence, qui caractérisent le niveau d’écotoxicité d’une substance ou d’un échantillon. Voici les plus utilisées (ac-lyon.fr, 2019 ; Dubuc, 2013) :
- la concentration sans effets observés CSEO (en anglais : NOEC) : c’est la concentration en substance/échantillon testé(e) la plus élevée pour laquelle aucun effet significativement différent du témoin n’a été observé ;
- la concentration minimale avec effets observés CMEO (en anglais : LOEC) : elle correspond à la concentration la plus faible pour laquelle un effet significativement différent du témoin a été observé.
- la concentration efficace CE50 (en anglais : EC50) : elle correspond à la concentration en substance/échantillon qui engendre un effet différent de 50 % par rapport au témoin. Pour une plante par exemple, ce peut être une croissance racinaire 50 % moins élevée que pour la plante témoin. Pour des animaux, ce peut être la mort de la moitié des organismes. La CE50 est déterminée statistiquement sur la base d’une modélisation.
Ces valeurs de référence sont largement utilisées par les chercheurs et dans la réglementation pour évaluer le danger et le risque environnemental liés à une substance chimique. Elles permettent en effet de calculer des valeurs seuils « à ne pas dépasser » dans le milieu naturel, telles que les PNEC (Predicted no effect concentration) et les NQE (Norme de Qualité Environnementale).
1.4 Synthèse des avantages et des limites d’un bioessai de laboratoire
| AVANTAGES | LIMITES |
| Les protocoles normalisés (pour une partie des tests) et les conditions d’exposition contrôlées permettent de comparer la toxicité de plusieurs substances/échantillons, même si les tests n’ont pas été réalisés au même moment ou par le même laboratoire | Faible réalisme environnemental en raison : -de l’utilisation d’organismes d’élevage -de l’exposition en conditions contrôlées de laboratoire qui sont très différentes des conditions de terrain |
| En cas d’exposition à un échantillon environnemental, les bioessais renseignent sur la fraction biodisponible et active du ou des contaminant(s) | Il est nécessaire de mettre en œuvre une batterie de bioessais (= plusieurs bioessais différents) afin de disposer des informations suffisantes à l’évaluation de la toxicité d’une substance ou d’un échantillon |
| L’exposition à un mélange de substances ou à un échantillon environnemental permet de prendre en compte les interactions entre contaminants (effets additifs, synergiques ou antagonistes) | En cas d’exposition à un échantillon environnemental, ils ne permettent pas à eux seuls d’identifier la ou les molécules(s) responsable(s) des effets observés |
| Certains bioessais (bioessais in vitro) permettent de décrire les mécanismes toxicologiques en jeu | Les bioessais de laboratoire ne prennent pas en compte les effets indirects des substances toxiques tels que les interactions entre espèces ou les effets trophiques (sauf dans les microcosmes) |
| Les valeurs de référence (CE50, CSEO, etc.) permettent d’établir des valeurs seuils utilisées dans la réglementation, telles que la PNEC (ex. : réglementation REACH) ou la NQE (Directive Cadre sur l’Eau) | En cas d’analyse d’échantillons environnementaux (ex. : eau de rivière), le prélèvement e le stockage des échantillons peuvent « fausser » la mobilité et la biodisponibilité des polluants présents |
Lire aussi | Les bioessais de laboratoire : évaluer la toxicité des polluants en conditions contrôlées
2. Les mésocosmes
2.1 Qu’est-ce qu’un mésocosme ?
Utilisés depuis les années 1970 en écologie et en écotoxicologie, les mésocosmes sont des systèmes expérimentaux délimités, plus ou moins clos, qui constituent des échelles intermédiaires entre le microcosme de laboratoire et la complexité du monde réel (Onema, 2009b).
Véritables « modèles réduits » de rivière (voir la vidéo de la rivière artificielle de l’INERIS), de plan d’eau ou encore de parcelles agricoles, ces plateformes expérimentales, généralement à l’air libre, permettent d’exposer des organismes vivants appartenant à différents niveaux trophiques dans des conditions environnementales « naturelles ».
Compromis intéressant entre le contrôle et la reproductibilité des expériences de laboratoire et la représentativité des études de terrain, les mésocosmes sont fréquemment utilisés dans le cadre de la constitution de dossiers réglementaires en vue de l’obtention de l’autorisation de mise sur le marché de substances chimiques telles que les pesticides. Ils demeurent en revanche sous-exploités par les gestionnaires en charge de la surveillance des milieux naturels (Onema, 2009b).
2.2 Synthèse des avantages et des limites des mésocosmes
| AVANTAGES | LIMITES |
| Réalisme plus important que pour les bioessais de laboratoire… | Mais réalisme moins important que lors d’études de terrain (mésocosme = écosystème « artificiel ») |
| Possibilité de suivre simultanément le devenir et les effets des polluants | Difficilement standardisable car la reproductibilité des conditions expérimentales est moindre que pour les bioessais de laboratoire |
| Mise en évidence d’effets directs et indirects au niveau d’un écosystème | Interprétation des données souvent difficile |
| En cas d’exposition à un échantillon environnemental, ils renseignent sur la fraction biodisponible et active du ou des contaminant(s) | Coût des installations et de la maintenance |
| L’exposition à un mélange de substances ou à un échantillon environnemental permet de prendre en compte les interactions entre contaminants (effets additifs, synergiques ou antagonistes) | |
| Ils peuvent être utilisés en complément des bioessais de laboratoire pour affiner l’évaluation de la toxicité d’une substance (ex. : optimisation de la PNEC) |
3. Les approches terrain
3.1 Prélèvement d’organismes autochtones
Cette approche, qui fait partie de la biosurveillance « passive », consiste à prélever des organismes sentinelles autochtones (= présents naturellement dans le milieu étudié), sur lesquels sont ensuite réalisées des analyses chimiques (mesure de la concentration d’une ou plusieurs substances) et écotoxicologiques (biomarqueurs).
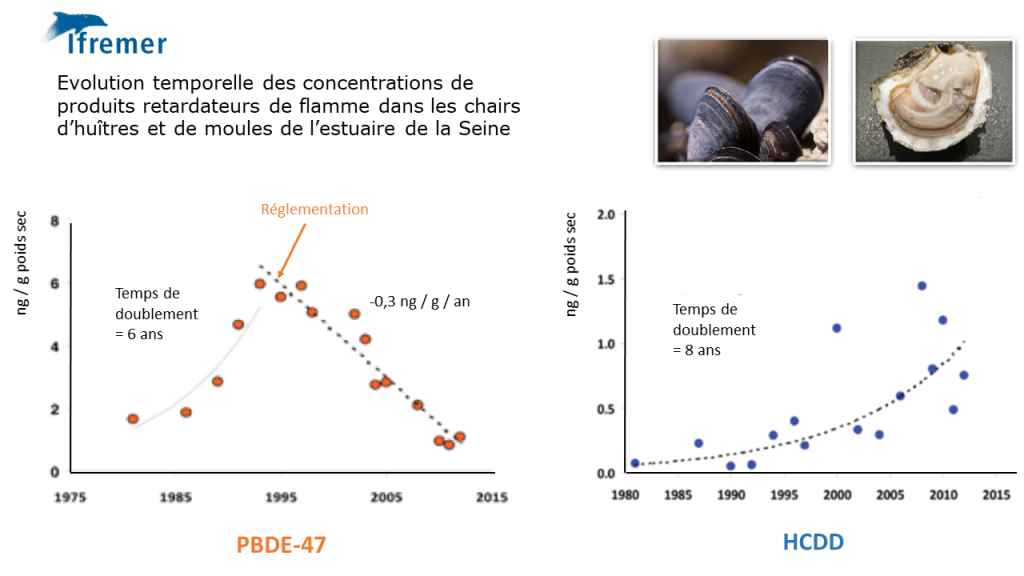
L’Ifremer utilise de longue date ce type d’approche pour évaluer l’état chimique des eaux côtières françaises (Onema, 2013) . En analysant les concentrations de PBDE-47 (un produit utilisé comme retardateur de flamme) dans les chairs d’huitre et de moules des eaux littorales, l’institut a montré que les mollusques vivant à proximité des secteurs industrialisés tels que l’estuaire de la Seine, étaient nettement plus contaminés que les autres.
Les résultats de ce suivi ont également mis en lumière l’impact des politiques publiques sur l’état des milieux : en forte croissance entre 1975 et 1995, les concentrations en PBDE dans les huitres et les moules ont ensuite nettement diminué… suite à la mise en œuvre d’une réglementation plus contraignante qui a permis de réduire la production de la substance et ses émissions dans l’environnement. En comparaison, les résultats obtenus pour l’hexabromocyclododécane (HBCDD), un retardateur de flamme non réglementé, ne montrent aucune inflexion temporelle.
3.2 Bioessais (ou « expérimentations ») in situ
Cette approche, qualifiée de biosurveillance « active », regroupe l’ensemble des expérimentations basées sur la manipulation d’organismes dans le milieu naturel (in situ). Les différents types d’expérimentations possibles sont résumées dans le tableau ci-après.
| TYPE D’EXPÉRIMENTATION | PRINCIPE | EXEMPLE(S) | ÉTAT DE DÉVELOPPEMENT |
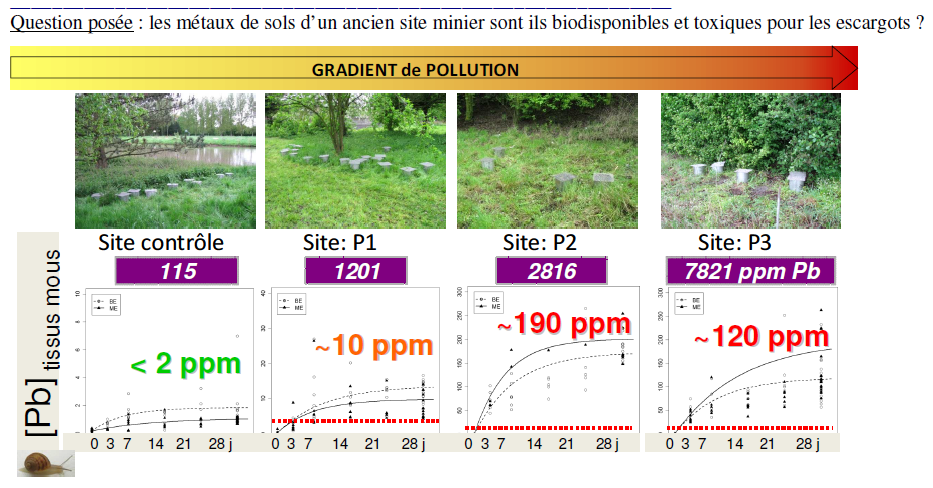
| Encagement d’organismes (caging) | Deux étapes : 1. Encagement dans le milieu d’étude, d’organismes de passé biologique connu*, pendant une durée donnée 2. Analyses chimiques (mesure de la bioaccumulation en polluants) et écotoxicologiques (biomarqueurs) sur les organismes encagés | -Encagement d’escargots sur un ancien site minier pour mesurer l’impact d’une pollution aux métaux lourds (voir illustration ci-après) (De Vaufleury, 2012) -Encagement de gammares (petites crevettes d’eau douce) pour mesurer l’état chimique d’une rivière (IRSTEA, 2014) | Cette approche est en plein développement et commence à « sortir » des laboratoires de recherche. L’outil « gammare » est par exemple utilisé par les agences de l’eau dans le cadre de la mise en œuvre de la DCE (Directive Cadre sur l’Eau) |
| Mise en place d’enclos | Emploi d’enceintes qui délimitent une portion d’un écosystème naturel | -Mise en place d’un enclos dans une portion de sol et application d’un pesticide pour en étudier les effets sur les organismes autochtones | Les approches par mésocosme et par encagement semblent aujourd’hui privilégiées par rapport aux enclos |
| Colonisation ou transplantation de substrat | Dépôt de substrats naturels (feuilles, galets, etc.) ou artificiels dans un milieu, sur lesquels vont se développer des communautés microbiennes / ou qui vont être décomposés par des micro-organismes et invertébrés | -Le PICT (Pollution-Induced Community Tolerance) appliqué au milieu aquatique : il s’agit de déposer dans une rivière des substrats artificiels sur lesquels vont se développer des communautés microbiennes autochtones puis de mesurer après 1 mois, l’adaptation de ces communautés à des substances spécifiques (ex. : pesticides) | Approche encore en phase de développement dans les laboratoires de recherche |
| Biocapteurs | Outils permettant de mesurer et de transformer un phénomène biologique/biochimique en signal physique (ex. : optique, électrique), pour suivre in situ et en continu l’impact d’un rejet polluant | -Un biocapteur algal, qui permet de mesurer l’impact des rejets polluants issus de déversoirs d’orage (Gosset, 2018) | Approche encore en phase de développement dans les laboratoires de recherche (mais premières applications proposées par certaines start-up) |
* Organismes prélevés dans un milieu naturel non pollué ou organismes d’élevage.
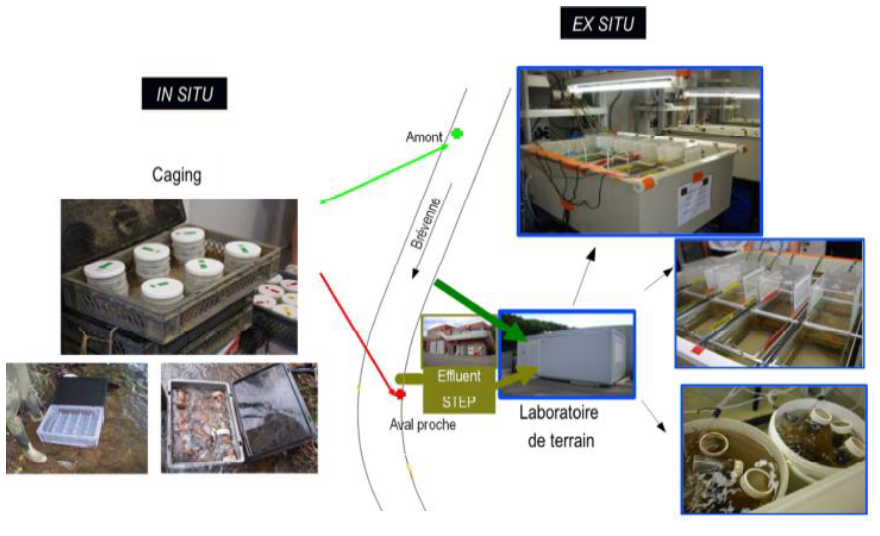
3.3 Bioessais (ou « expérimentations ») ex situ
Cette approche consiste à installer un laboratoire sur site, afin de créer des conditions d’expérimentation contrôlées sur le terrain d’étude.
Un exemple : si on souhaite mesurer l’impact du rejet d’une station d’épuration sur une rivière, on peut mettre en place un système de dérivation de l’effluent et de l’eau de la rivière vers un laboratoire. Ce système permettra de faire des dilutions et de tester les effets de différentes concentrations d’effluent sur des organismes modèles (Berlioz-Barbier, 2015).
3.4 Synthèse des avantages et des limites des approches terrain
| AVANTAGES | LIMITES |
| Réalisme environnemental (prélèvement d’organismes autochtones > bioessais in situ > bioessais ex situ) | Hormis pour les bioessais ex situ, les conditions d’exposition sont peu (bioessais in situ) ou pas (prélèvement d’organismes autochtones) contrôlées => expérimentations peu ou pas reproductibles |
| Prise en compte des facteurs environnementaux (ex. : température, pH, oxygène, nutriments, habitat, etc.) pouvant influencer les effets des polluants | Standardisation et définition de valeurs seuils délicates, en raison de l’influence des facteurs environnementaux et individuels sur les effets observés (les approches par encagement atténuent cependant ce problème) |
| Prise en compte des interactions entre contaminants (effets additifs, synergiques ou antagonistes) | Pour l’encagement d’organismes : l’encagement peut perturber l’exposition à la lumière, réduire la teneur en oxygène, etc. ce qui peut influencer les résultats observés (nécessité de prendre en compte ces artéfacts) (ZABR, 2009) |
| Approches permettant d’évaluer « l’état de santé » d’un milieu donné (biosurveillance) | Pour le prélèvement d’organismes autochtones : le diagnostic basé sur l’observation d’effets ou la mesure de biomarqueurs peut être biaisé si les populations du milieu sont devenues résistantes à la pression chimique (INRAE, 2020) |
4. La modélisation
4.1 Qu’est-ce que la modélisation en écotoxicologie ?
Les connaissances en écotoxicologie, chimie, biologie, écologie et mathématiques permettent aux démarches de modélisation d’apporter de réelles plus-values par rapport aux approches de laboratoire et de terrain décrites ci-avant.
L’utilisation de modèles peut notamment permettre :
- de prédire l’effet ou le comportement d’une molécule d’après sa structure chimique, via l’approche QSAR (Quantitative structure-activity relationship) : les modèles QSARs sont utilisés depuis 1981 par l’EPA (Etats-Unis) pour prédire la toxicité aquatique des nouvelles substances chimiques industrielles en l’absence de données de toxicité ; ils sont également utilisés en Europe dans le cadre des procédures d’évaluation des risques (Aiida, 2014) ;
- de prédire l’effet d’un mélange de molécules sur un organisme, à partir de la connaissance de l’effet de chacune des molécules composant ce mélange ;
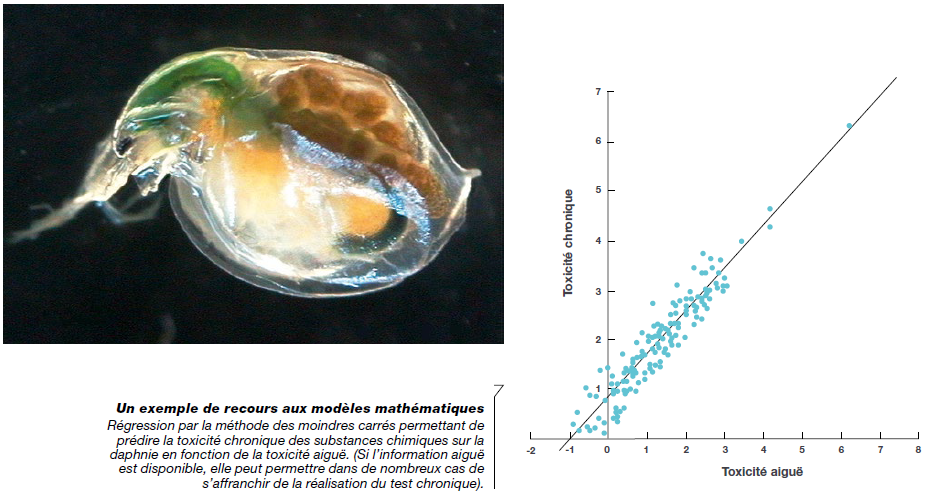
- de prédire la toxicité chronique (long terme) de substances chimiques sur un organisme à partir de données sur la toxicité aigüe (court terme) (voir illustration ci-après avec la daphnie – INERIS, 2013) ;
- de mettre en relation les effets au niveau des cibles biologiques, des individus, des populations et potentiellement des communautés (Pery, 2009).
4.2 Synthèse des avantages et des limites de la modélisation
| AVANTAGES | LIMITES |
| Pas d’organismes vivants sacrifiés dans des expérimentations | L’expérimentation sur le vivant reste nécessaire en complément |
| Plus économique (temps et matériel) que les approches de laboratoire et de terrain | Le recul et la fiabilité de ces modèles restent à ce jour globalement insuffisants (INERIS, 2013) |
| Les modèles QSARs sont préconisés pour (Aiida, 2014) : -aider à l’évaluation des données écotoxicologiques -contribuer au processus de prise de décision (tests supplémentaires, priorité…) -identifier des effets de préoccupation potentielle pour lesquels des données écotoxicologiques ne sont pas disponibles | L’utilisation de QSAR en l’absence de données peut provoquer de grandes variabilités par rapport à la réalité (Aiida, 2014) |

Article rédigé par Vivien Lecomte, 6 septembre 2021 – Ecotoxicologie.fr : tous droits réservés
EN SAVOIR PLUS
–Directrice européenne cadre sur l’eau : bilan de 20 années de recherche pour la reconquête des masses d’eau – Numéro spécial de la revue Sciences Eaux & Territoires, 2021
–La contamination chimique des milieux aquatiques : outils et méthodes pour le diagnostic et l’action – Synthèse d’un séminaire de l’ONEMA, 2013
–Le risque écotoxicologique dans le bassin de la Seine – Programme PIREN-Seine, 2011
–MOSAIC, plateforme web de services d’analyse de données d’écotoxicité (Université Lyon 1)
-Manier N., Aït-Aïssa S. et Pandard P. (2023). Inventaire et évaluation des méthodes biologiques issues de l’écotoxicologie pour la surveillance des milieux aquatiques en vue de leur utilisation dans le cadre de la DCE. Compte-rendu des activités du groupe de travail national sur les bioessais animé par l’OFB et Aquaref. https://www.aquaref.fr/system/files/Aquaref_2021_FG1.3c1_Inventaire_evaluation_bioessais_DCE_VF.pdf
–NORMAN Guidance on suspect and non target screening in environmental monitoring (screening non ciblé), 2023
| Vous avez apprécié cet article ? Soutenez Ecotoxicologie.fr et contribuez à son développement avec petit don 🙂 |





 Il se vend près de 6 shampoings chaque seconde en France soit près de 200 millions de bouteilles par an
Il se vend près de 6 shampoings chaque seconde en France soit près de 200 millions de bouteilles par an Les produits d’entretien classiques contiennent des tensioactifs (appelés aussi agents de surface ou détergents) qui permettent d’éliminer les graisses et autres salissures à la surface de matériaux. Les détergents anioniques (charge négative) et amphotériques (dont la charge dépend du pH de l’eau) sont particulièrement présents dans les produits nettoyants, en raison de leurs propriétés nettoyantes et moussantes
Les produits d’entretien classiques contiennent des tensioactifs (appelés aussi agents de surface ou détergents) qui permettent d’éliminer les graisses et autres salissures à la surface de matériaux. Les détergents anioniques (charge négative) et amphotériques (dont la charge dépend du pH de l’eau) sont particulièrement présents dans les produits nettoyants, en raison de leurs propriétés nettoyantes et moussantes  Les phtalates, produits à quelque 6 millions de tonnes par an dans le monde
Les phtalates, produits à quelque 6 millions de tonnes par an dans le monde  20 millions de lave-linge tournent en France chaque jour en moyenne
20 millions de lave-linge tournent en France chaque jour en moyenne  La France est le 4ème consommateur mondial de médicaments : plus de 3000 médicaments à usage humain et 300 médicaments vétérinaires sont actuellement disponibles sur le marché français. Une fois que ces substances ont agi dans l’organisme, elles sont excrétées, essentiellement dans les selles et les urines, puis relarguées dans les réseaux d’eaux usées (médicaments humains) et dans les sols (médicaments vétérinaires). Une partie de ces résidus de médicaments se retrouvent donc d’une manière ou d’une autre dans le milieu aquatique. Des traces de ces composés sont d’ailleurs régulièrement détectées dans les eaux de surface et même dans les eaux de nappe
La France est le 4ème consommateur mondial de médicaments : plus de 3000 médicaments à usage humain et 300 médicaments vétérinaires sont actuellement disponibles sur le marché français. Une fois que ces substances ont agi dans l’organisme, elles sont excrétées, essentiellement dans les selles et les urines, puis relarguées dans les réseaux d’eaux usées (médicaments humains) et dans les sols (médicaments vétérinaires). Une partie de ces résidus de médicaments se retrouvent donc d’une manière ou d’une autre dans le milieu aquatique. Des traces de ces composés sont d’ailleurs régulièrement détectées dans les eaux de surface et même dans les eaux de nappe  On estime que 4000 à 6000 tonnes d’écran total sont libérées chaque année dans les zones de récifs tropicales par les 78 millions de touristes qui s’y rendent
On estime que 4000 à 6000 tonnes d’écran total sont libérées chaque année dans les zones de récifs tropicales par les 78 millions de touristes qui s’y rendent  En raison de son faible coût, l’huile de palme est, depuis quelques années, très utilisée dans l’alimentation: elle est présente dans 1 produit alimentaire empaqueté sur deux vendus en Europe (chips, biscuits, crème glacée, etc.). Or, la plantation de palmiers est à l’origine de déforestation, notamment en Indonésie. Dans ce pays, 3 millions d’hectares de forêt tropicale ont été détruits à cet effet entre 1990 et 2005 et le gouvernement prévoit un plan d’expansion des plantations de palmiers à huile de 14 millions d’hectares. La conversion des forêts en palmiers à huile a montré une perte de 80 à 100% des espèces de mammifères (dont l’orang-outan), reptiles et d’oiseaux dans ces zones
En raison de son faible coût, l’huile de palme est, depuis quelques années, très utilisée dans l’alimentation: elle est présente dans 1 produit alimentaire empaqueté sur deux vendus en Europe (chips, biscuits, crème glacée, etc.). Or, la plantation de palmiers est à l’origine de déforestation, notamment en Indonésie. Dans ce pays, 3 millions d’hectares de forêt tropicale ont été détruits à cet effet entre 1990 et 2005 et le gouvernement prévoit un plan d’expansion des plantations de palmiers à huile de 14 millions d’hectares. La conversion des forêts en palmiers à huile a montré une perte de 80 à 100% des espèces de mammifères (dont l’orang-outan), reptiles et d’oiseaux dans ces zones  Les animaux se nourrissent d’aliments (céréales, petits animaux, etc.) contenant différents polluants. Au fil du temps, ces derniers s’accumulent dans l’organisme de l’animal et en particulier dans les graisses (phénomène de bioaccumulation). Ainsi, une étude de 2010 a révélé la présence de nombreux pesticides et de PCB dans du saumon et du steak haché achetés dans des supermarchés de la région parisienne
Les animaux se nourrissent d’aliments (céréales, petits animaux, etc.) contenant différents polluants. Au fil du temps, ces derniers s’accumulent dans l’organisme de l’animal et en particulier dans les graisses (phénomène de bioaccumulation). Ainsi, une étude de 2010 a révélé la présence de nombreux pesticides et de PCB dans du saumon et du steak haché achetés dans des supermarchés de la région parisienne  Tout comme les fruits et légumes, le riz peut contenir différents polluants tels que des pesticides, en particulier s’il est issu d’une agriculture intensive classique (non « bio »). Ainsi, une étude de 2010 a révélé la présence d’isoprothiolane et de tricyclazole, 2 pesticides interdits d’usage en Europe, dans du riz acheté dans des supermarchés de la région parisienne
Tout comme les fruits et légumes, le riz peut contenir différents polluants tels que des pesticides, en particulier s’il est issu d’une agriculture intensive classique (non « bio »). Ainsi, une étude de 2010 a révélé la présence d’isoprothiolane et de tricyclazole, 2 pesticides interdits d’usage en Europe, dans du riz acheté dans des supermarchés de la région parisienne  L’eau du robinet est globalement de bonne qualité en France et les normes en vigueur sont généralement respectées
L’eau du robinet est globalement de bonne qualité en France et les normes en vigueur sont généralement respectées  Les fruits et légumes issus de l’agriculture intensive « classique » (c’est à dire non « bio ») contiennent des mélanges à faibles doses de substances chimiques classées, par les instances officielles, cancérogènes certaines, probables ou possibles ou soupçonnées d’être perturbatrices du système endocrinien. C’est ce qu’illustre notamment une étude de 2010 qui a révélé la présence de nombreux pesticides dans des produits achetés dans des supermarchés de la région parisienne
Les fruits et légumes issus de l’agriculture intensive « classique » (c’est à dire non « bio ») contiennent des mélanges à faibles doses de substances chimiques classées, par les instances officielles, cancérogènes certaines, probables ou possibles ou soupçonnées d’être perturbatrices du système endocrinien. C’est ce qu’illustre notamment une étude de 2010 qui a révélé la présence de nombreux pesticides dans des produits achetés dans des supermarchés de la région parisienne  Le lave-vaisselle est généralement moins consommateur en eau (12 L) que le lavage à la main qui dépend beaucoup du manipulateur (10 à 50 L)
Le lave-vaisselle est généralement moins consommateur en eau (12 L) que le lavage à la main qui dépend beaucoup du manipulateur (10 à 50 L)  Le liquide vaisselle est un détergent composé d’agents nettoyants appelés tensioactifs, mais aussi de colorants, conservateurs et parfums de synthèse. Bien que les tensioactifs ont l’obligation d’être biodégradables à 90%
Le liquide vaisselle est un détergent composé d’agents nettoyants appelés tensioactifs, mais aussi de colorants, conservateurs et parfums de synthèse. Bien que les tensioactifs ont l’obligation d’être biodégradables à 90%  Les composés perfluorés (PFC), tels que le téflon, ont la propriété de repousser l’eau, les matières grasses et la poussière. Ils sont ainsi utilisés comme antiadhésif dans de nombreuses poêles et casseroles. Les PFC sont persistants et s’accumulent dans les êtres vivants: certaines études ont révélé la présence de certains PFC dans les cours d’eau et les poissons (dans le foie notamment) ainsi que dans le sang humain
Les composés perfluorés (PFC), tels que le téflon, ont la propriété de repousser l’eau, les matières grasses et la poussière. Ils sont ainsi utilisés comme antiadhésif dans de nombreuses poêles et casseroles. Les PFC sont persistants et s’accumulent dans les êtres vivants: certaines études ont révélé la présence de certains PFC dans les cours d’eau et les poissons (dans le foie notamment) ainsi que dans le sang humain  3,8 millions de tonnes de bisphénol A (BPA) ont été produits en 2006
3,8 millions de tonnes de bisphénol A (BPA) ont été produits en 2006  Ces bouteilles contiennent notamment des phtalates, produits chimiques utilisés en tant que plastifiants et qui font partie de la famille des
Ces bouteilles contiennent notamment des phtalates, produits chimiques utilisés en tant que plastifiants et qui font partie de la famille des