Perturbateurs endocriniens : quels sont leurs effets sur l’environnement ?
Introduction
Historiquement, les perturbateurs endocriniens ont commencé à attirer l’attention des chercheurs dès les années 1950. Les scientifiques se sont alors alarmés d’anomalies de la fonction de reproduction (mutations sexuelles, comportements inhabituels, etc.) observées chez de nombreuses espèces animales ainsi que chez les humains. Les études écologiques ont notamment mis en évidence :
- Des problèmes de reproduction chez les goélands liés à l’amincissement de la coquille des œufs (années 1970) ;
- Une « masculinisation » de femelles gastéropodes au niveau des zones portuaires (années 1970) ;
- L’altération des capacités de reproduction et de la fonction immunitaire des phoques en mer Baltique, entraînant une diminution des populations (années 1980) ;
- Un développement anormal du pénis chez les alligators dans les lacs pollués au DDE (métabolite de l’insecticide DDT) en Floride (années 1990) ;
- Une féminisation des téléostéens (poissons à sexes séparés) dans les eaux terrestres (rivières, lacs) et marines, avec réduction de la spermatogenèse (processus aboutissant à la formation des spermatozoïdes) et apparition d’ovocytes dans les organes sexuels mâles (années 1990).
Mais c’est l’affaire du distilbène, une hormone de synthèse, qui dans les années 1970 a fait exploser le sujet des perturbateurs endocriniens sur la scène scientifique et médiatique, alors même que ce terme n’était pas encore utilisé. En France, ce produit pharmaceutique a été très largement prescrit aux femmes enceintes entre 1948 et 1977 pour prévenir les fausses couches. Or, les études de l’époque ont révélé que l’exposition de la mère au distilbène pouvait avoir des conséquences dramatiques sur la descendance : anomalies du développement de l’appareil reproducteur, stérilité, cancers de l’appareil reproducteur chez les filles, incidence accrue de l’hypopsadie (pénis de petite taille), de la cryptochirdie (absence de descente des testicules) et des anomalies de la spermatogenèse chez les garçons. Plusieurs études récentes suggèrent même de possibles répercussions chez les petits-enfants de femmes ayant pris du distilbène (DES France, 2023).
Mais le distilbène n’est malheureusement pas le seul perturbateur endocrinien auquel nous sommes exposés. Ainsi, vous avez certainement déjà entendus que depuis plusieurs décennies, la fertilité de l’espèce humaine avait tendance à diminuer, tandis que les phénomènes de puberté précoce chez les filles et de cryptorchidies chez les garçons devenaient plus fréquents. Aujourd’hui, on sait que ces perturbations sont d’origine hormonale (= endocrinienne) et ne se limitent pas à l’appareil reproducteur, mais affectent aussi le métabolisme (problèmes d’obésité et de diabète) et les comportements neuro-développementaux. Ces altérations du système endocrinien, très préoccupantes chez l’homme, conduisent au déclin de certaines populations animales.
Comment se définit un perturbateur endocrinien ? Quelles sont les substances chimiques concernées ? Comment ces substances agissent-elles sur les hormones et quels sont leurs effets sur les organismes et les écosystèmes ? Autant de questions que je vous propose de creuser dans le cadre de cet article.
1. LE SYSTÈME ENDOCRINIEN ET LES HORMONES
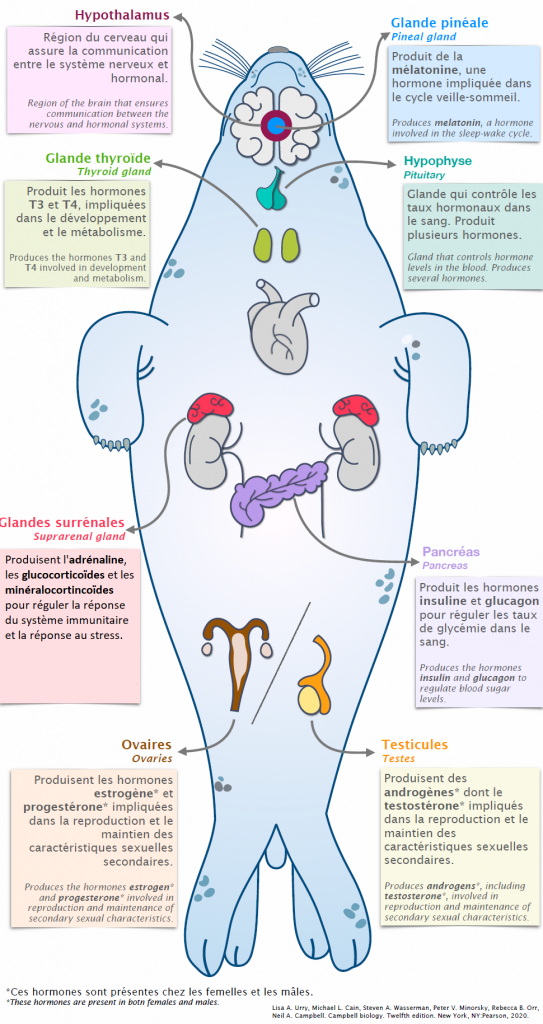
Le système endocrinien fait référence au système hormonal des animaux (cf. figure 1). Il est constitué de glandes qui sécrètent les hormones, comme l’hypophyse, la thyroïde, le pancréas endocrine, les ovaires et les testicules ou de cellules comme celles de l’estomac qui sécrètent la gastrine et la ghréline, celles de l’intestin qui sécrètent la sécrétine et la cholécystokinine, ou les cellules adipeuses qui sécrètent les adipokines.
Les hormones sont des molécules secrétées dans le sang qui vont agir à distance sur différents organes pour assurer le bon fonctionnement de l’organisme. Chez les invertébrés, les hormones circulent au niveau de l’hémolymphe. Le système endocrinien est donc un moyen de communication entre les cellules.
Les cellules émettrices, dites endocrines, sécrètent des hormones de natures chimiques diverses (peptides ou polypeptides, stéroïdes, ou des hormones dérivées de la tyrosine) qui agissent à très faibles doses (de 10-12 à 10-9 mol/L) sur des cellules cibles. La liaison entre l’hormone et la cellule cible se fait au niveau d’un récepteur cellulaire.
Qu’est-ce qu’un récepteur cellulaire ?
Le récepteur à une hormone peut être assimilé à une serrure où vient se loger la clé qui est l’hormone. La liaison hormone-récepteur conduit à la réponse biologique. Il existe deux familles de récepteurs : les récepteurs membranaires (l’hormone ne pénètre pas dans la cellule) et les récepteurs nucléaires qui agissent sur le génome (l’hormone pénètre dans la cellule).
2. QU’EST-CE QU’UN PERTURBATEUR ENDOCRINIEN ?
2.1 Définition
En juillet 1991, la conférence de Wingspread dans le Wisconsin, rassemblant de nombreux scientifiques d’horizons divers, se révèle être un tournant décisif. C’est là qu’émerge pour la première fois le terme de « perturbateurs endocriniens », accompagné du commentaire suivant : « Nous sommes certains qu’un grand nombre de produits chimiques fabriqués par l’homme déversés dans l’environnement ainsi que certains produits naturels, ont le potentiel de perturber le système endocrinien animal, y compris celui des êtres humains ».
Mais c’est au début des années 2000 que l’Organisation Mondiale de la Santé (OMS) apportera une définition officielle de ce terme. Un perturbateur endocrinien (PE) est alors défini comme un xénobiotique (c.à.d. une substance qui provient de l’extérieur de l’organisme, que l’on peut qualifier également de substance exogène) ou comme un mélange de xénobiotiques qui altère le (ou les) fonction(s) du système endocrinien et provoque par conséquent des effets néfastes sur la santé d’un organisme, de sa descendance ou de ses sous-populations (OMS/PISSC, 2002).
Selon l’Union européenne (règlement (CE) n° 1107/2009 relatif aux produits phytopharmaceutiques et règlement (UE) n° 528/2012 relatif aux produits biocides), trois conditions sont nécessaires pour qu’une substance puisse être qualifiée de PE. Elle devra (i) produire un effet négatif et (ii) avoir un mode d’action qui altère les fonctions du système hormonal. Mais surtout, (iii) il faudra démontrer que cet effet négatif est une conséquence directe de ce mode d’action.
Cette définition est considérée comme trop restrictive par les scientifiques et les ONG car pour de nombreuses substances suspectées d’être des PE, il s’avère très complexe de mettre en évidence le mode d’action. En outre, les effets apparaissent souvent sur le long terme, parfois très longtemps après l’exposition. On sait désormais que l’exposition à de faibles concentrations d’un PE peut causer des effets irréversibles ou non et décalés dans le temps. Pour ajouter à la complexité, ces effets peuvent n’apparaître que lorsque l’exposition a eu lieu à des moments précis du développement de l’organisme (cf. partie 3.2 Fenêtre de vulnérabilité). C’est ainsi que l’on a découvert que l’exposition des embryons à des produits mimant les hormones naturelles entraînait des anomalies irréversibles de l’appareil reproducteur.
Vous comprenez alors pourquoi il est difficile d’affirmer qu’une substance chimique donnée est (ou n’est pas) un PE.
10 critères pour caractériser les perturbateurs endocriniens (chez l’humain) :
Si le terme “perturbateur endocrinien” est largement utilisé dans la presse et par le public, les scientifiques ne sont pas vraiment d’accord sur ce qu’est in fine un perturbateur endocrinien (Chèvre, 2021). Ainsi, en 2019, un groupe d’experts en endocrinologie issus de différents pays a publié une liste de 10 critères pour caractériser les PE (La Merrill et al, 2019), de manière similaire à ce qui se fait pour définir des substances cancérigènes. Mais tous ces critères sont définis pour l’être humain : s’ils peuvent s’appliquer pour les vertébrés, ce n’est pas le cas pour les invertébrés ou pour les plantes (Chèvre, 2021).
2.2 Les mécanismes d’action des perturbateurs endocriniens
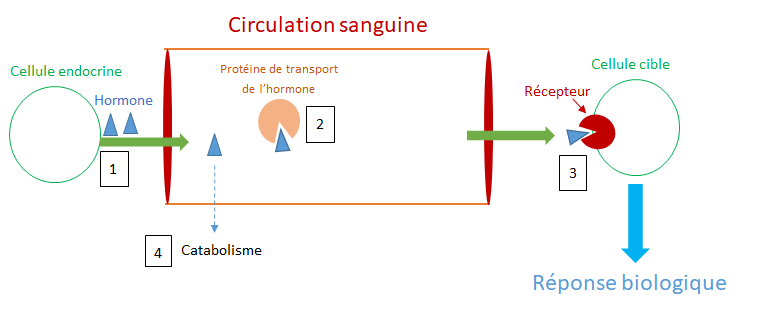
Comme illustré sur la figure 2, un PE peut interférer avec chacune des phases de la « vie » d’une hormone naturelle : la synthèse (production) de l’hormone (1), sa libération dans le sang, son transport (2), sa liaison au récepteur cellulaire (3), son action, son métabolisme (transformation) et/ou son élimination (4). Du fait de la concentration très faible à partir de laquelle les hormones agissent, une légère perturbation de l’une de ces phases peut altérer la réponse cellulaire et entraîner des effets délétères parfois irréversibles sur l’organisme ou sa descendance.
Les PE participent aussi aux modifications épigénétiques du génome (voir encart), conduisant à des effets transgénérationnels. La transmission transgénérationnelle se produit lorsque la descendance (F1) transmet ensuite ces effets à des descendants qui n’ont pas été exposés à l’événement traumatique initial (ici, l’exposition à un PE), au moins jusqu’aux « petits-enfants » (F2) et aux « arrière-petits-enfants » (F3).
L’effet de PE a été mis en évidence sur un certain nombre d’hormones, telles que les androgènes (hormones associées aux caractères mâles chez les vertébrés – ex. : la testostérone), les œstrogènes (hormones associées aux caractères femelles – ex. : l’œstradiol) et les hormones thyroïdiennes (ex. : la thyroxine – T4- et la triiodothyronine – T3).
Épigénétique : de quoi parle-t-on ?
L’épigénétique se penche sur une couche d’informations complémentaires qui influence l’utilisation des gènes par une cellule, sans modifier leur séquence d’ADN. Ces modifications épigénétiques sont réversibles et peuvent être transmises lors des divisions cellulaires. Contrairement aux mutations génétiques, elles n’affectent pas directement la séquence nucléotidique de l’ADN. Les facteurs environnementaux peuvent induire des modifications épigénétiques. Ces changements sont matérialisés par des marques biochimiques apposées sur l’ADN ou sur les protéines qui le structurent.
2.3 La dose ne fait pas le poison
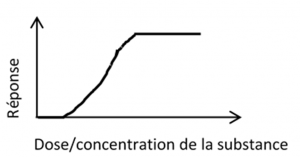
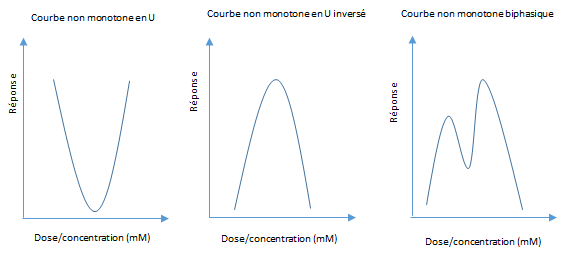
Vous connaissez peut-être le célèbre paradigme de Paracelse selon lequel « rien n’est poison, tout est poison, seule la dose fait le poison ». Selon ce dicton, la toxicité d’une substance est nulle à « faible dose » puis augmente avec la dose jusqu’à atteindre un plateau. Cette relation entre la dose de la substance et l’effet associé (réponse) peut être représentée par une courbe dose-réponse sigmoïde dite monotone (cf. figure 3).
Si la relation monotone entre la dose d’un polluant et son effet est le cas le plus fréquemment observé, les PE échappent à la règle. Ils peuvent en effet agir à de très faibles doses au même titre que les hormones ou bien à très fortes doses, conduisant à des courbes dites non monotones, en U, en U inversé, ou à des courbes biphasiques (cf. figure 4).
2.4 Dans quels produits trouve-t-on des perturbateurs endocriniens ?
Les études scientifiques ont permis d’identifier de nombreux PE de nature et d’usage très variés (cf. figure 5) :
- des hormones naturelles telles que l’estrone (E1), l’estradiol (E2) et l’estriol (E3) ;
- des substances naturelles d’origine végétale (« phytoestrogènes ») telles que la génistéine (soja) et le coumestrol (trèfle, luzerne, etc.) ;
- des substances chimiques fabriquées par l’homme telles que des biocides (ex. : tributylétain -TBT), des tensioactifs (ex. : alkylphénols, PFAS), des filtres UV (ex. : benzophénones), des pesticides (ex. : DDT), des agents plastifiants (ex. : phtalates, bisphénols) et des retardateurs de flamme (ex. : PBDE) ;
- des produits pharmaceutiques comme l’éthinylœstradiol (EE2 : principe actif de la pilule contraceptive) et les traitements contre les cancers hormono-dépendants (cancers des testicules, de la prostate, du sein, de l’utérus, des ovaires) dont le tamoxifène.
D’après le rapport OMS-PNUE 2012, près de 800 substances chimiques ont des propriétés perturbatrices endocriniennes avérées ou suspectées.

3. LES ORGANISMES SONT EXPOSÉS DÈS LA PÉRIODE EMBRYONNAIRE
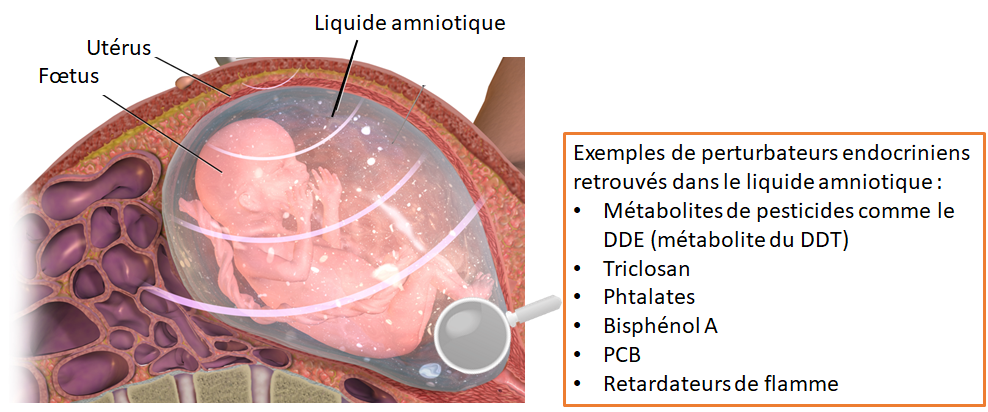
3.1 Des perturbateurs endocriniens dans le liquide amniotique et dans les œufs
Chez les mammifères, les PE présents dans le sang maternel se retrouvent dans le liquide amniotique (cf. figure 6). Ces mêmes molécules sont aussi retrouvées dans les œufs de reptiles, d’amphibiens et de poissons.
3.2 La fenêtre de vulnérabilité
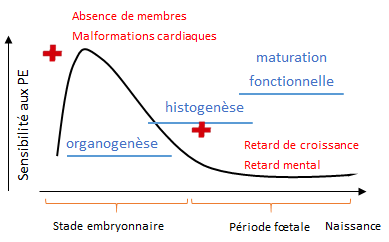
Pendant son développement, l’organisme est exposé à de nombreux PE. L’action d’un PE dépend non seulement de sa dose mais aussi du stade de développement où l’exposition survient. En effet, les hormones agissent à des moments précis du développement, et c’est pendant ces moments que l’organisme est sensible aux déséquilibres hormonaux, et donc aux PE. On parle de « fenêtres de vulnérabilité » (cf. figure 7). Un PE peut avoir des conséquences directes et perturber le développement mais peut aussi conduire à des changements permanents silencieux qui ne se manifesteront qu’à l’âge adulte (mutations sexuelles, comportements sexuels inhabituels, stérilité chez de nombreuses espèces, cancers hormonodépendants, démences séniles chez l’Homme). Chez les mammifères et les vertébrés ovipares (qui se reproduisent avec des œufs), le stade embryonnaire, dont le développement est sous contrôle hormonal, est la période où les organismes sont les plus vulnérables aux PE. Néanmoins, la période fœtale chez les mammifères, le stade juvénile ou larvaire chez les autres vertébrés sont aussi sensibles aux PE (notamment pour le développement du système nerveux et la métamorphose qui sont sous la dépendance des hormones thyroïdiennes).
4. EFFETS DES PE SUR LA SYNTHÈSE DES HORMONES
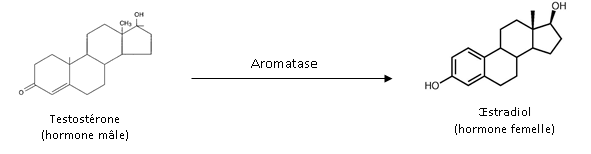
La synthèse des hormones peut être inhibée ou stimulée par certains PE. Ainsi, l’aromatase (Cyp19), enzyme à l’origine de la synthèse de l’œstradiol (hormone femelle) à partir de la testostérone (hormone mâle) (cf. figure 8), est une cible bien connue de certains PE. Comme nous allons le voir avec les exemples ci-après, une modification de son activité peut entrainer des effets « masculinisants » ou « féminisants » chez les organismes exposés.
4.1 L’atrazine, un herbicide qui féminise des grenouilles mâles
L’atrazine est un herbicide couramment utilisé aux États-Unis et dans le monde. Il est interdit en Europe depuis 2004 en raison de sa toxicité avérée. Souvent utilisé dans la culture du maïs, il contamine les eaux souterraines et de surface. Chez les amphibiens, l’atrazine induit une augmentation de l’activité de l’aromatase et diminue de ce fait la concentration de testostérone (cf. figure 9). Les études montrent ainsi que l’exposition à de faibles doses d’atrazine transforme les grenouilles mâles en castrats ou en femelles (Tyrone et al, 2002).

4.2 Le tributylétain (TBT), un biocide qui masculinise des femelles de gastéropodes marins
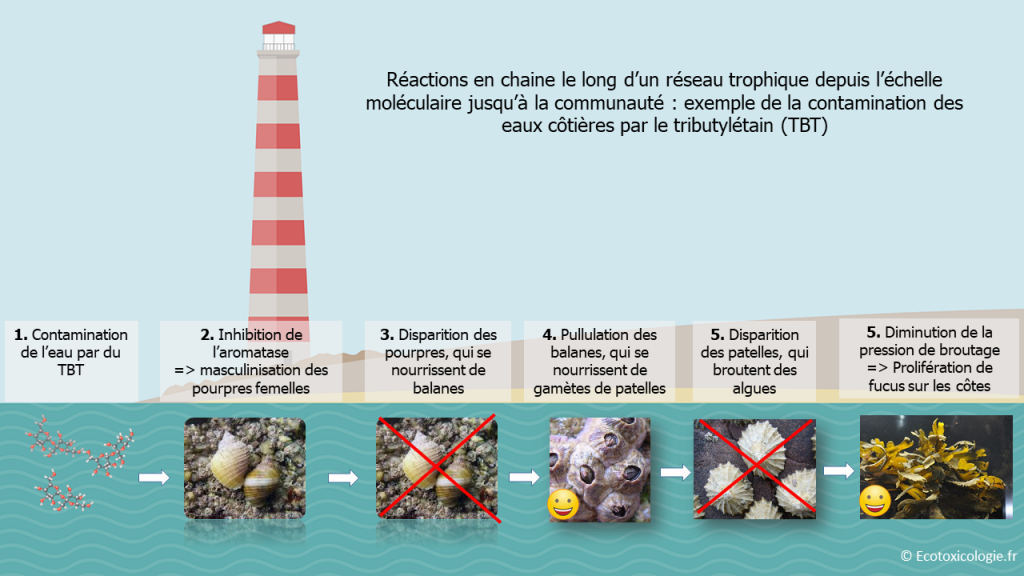
Le tributylétain (TBT) est une substance présente dans les peintures antifouling, largement utilisée au XXème siècle sur les coques de bateaux. Désormais interdit d’usage en France, il était destiné à empêcher la prolifération d’organismes vivants sur les coques qui ralentissait les bateaux, entraînant une augmentation de la consommation de carburants. Du fait de ses effets environnementaux et de sa rémanence (persistance) dans l’environnement, le TBT est une des substances prioritaires surveillées dans les eaux au niveau européen dans le cadre de la Directive cadre sur l’eau. En effet, des études ont montré qu’il provoquait l’apparition d’organes sexuels mâles (un pénis et un canal déférent) chez les gastéropodes femelles présentes dans les ports ou sur les trajets maritimes des bateaux. Ce phénomène appelé « imposex » est le résultat d’une inhibition de l’aromatase par le TBT : l’aromatase cesse de convertir la testostérone en œstradiol, provoquant ainsi une augmentation du taux d’hormones mâles chez les gastéropodes femelles. Il existe plusieurs stades de « masculinisation » en fonction de la concentration de TBT dans le milieu marin. Chez la femelle du pourpre (Nucella lapillus), les différents stades de masculinisation ont été bien identifiés (cf. figure 10):
- Stade 1 : Apparition de l’ébauche d’un pénis derrière le tentacule oculaire droit ;
- Stade 2 : Développement d’un canal déférent près de la papille génitale ;
- Stade 3 : Pénis qui s’allonge et se prolonge dans la partie proximale du canal déférent (vas deferens) ;
- Stade 4 : Fusion du canal déférent et du pénis qui s’est allongé ;
- Stade 5 : Les cellules du canal défèrent prolifèrent autour de la papille génitale ➠ obstruction de son ouverture ;
- Stade 6 : Avortement des capsules d’œufs de la capsule glandulaire.
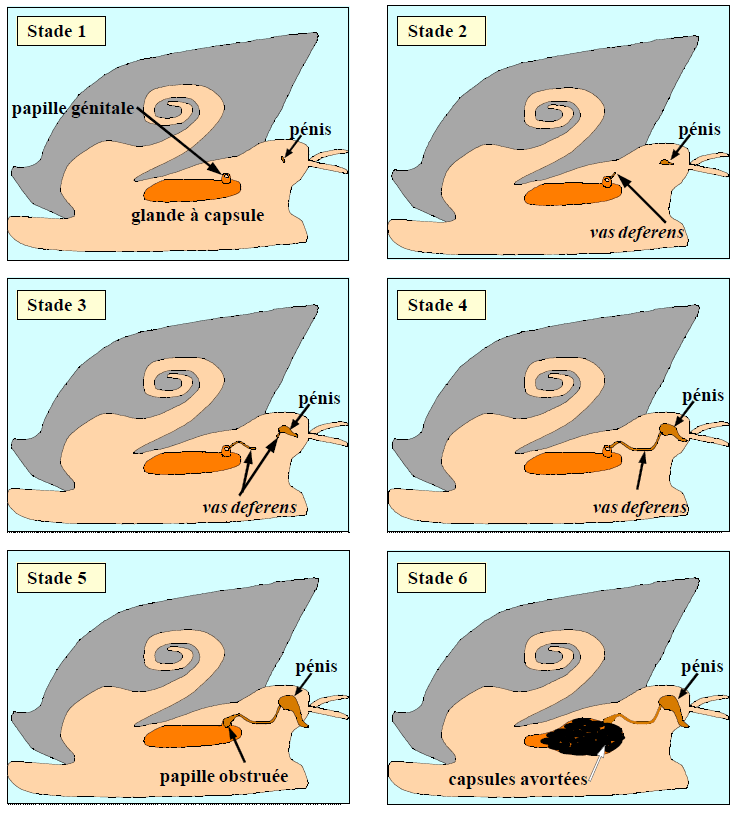
Des doses infimes de TBT (0,1 ng/L) peuvent induire l’imposex comme par exemple chez Ocinebra aciculata (Oelmann et al, 1996) et des doses très faibles (2,4 ng/L) peuvent conduire à la stérilité totale des femelles (Schoyen et al, 2019). Ces stades sont analysés sur Nucella lapillus comme bioindicateur des taux de TBT dans l’environnement. On utilise alors la taille relative du pénis (RPSI – Relative Penis Size Index) des femelles ainsi que les séquences de formation du canal déférent (VDSI – Vas deferens Sequence Index) (Bryan et al, 1986).
4.3 Les effets de l’insecticide DDT sur les oiseaux et les alligators
Le DDT (dichlorodiphényldichloroéthane), insecticide de la famille chimique des organochlorés, a été intensément utilisé à partir du début de la deuxième guerre mondiale contre les insectes ravageurs des cultures et les insectes porteurs de maladies (cf. figure 11) (INERIS, 2007).

Cependant, des effets toxiques très importants ont été démontrés vis à vis des populations aquatiques et terrestres dans les régions régulièrement traitées par ce pesticide pour la démoustication. Prenons deux exemples.
Le premier exemple nous emmène en Floride, dans le lac Apopka, et est directement en lien avec la synthèse hormonale. Dans les années 1990, on constata une diminution importante du nombre d’alligators et une augmentation des mâles présentant un micropénis et diverses anomalies des testicules (Guillette, 1994). Conjointement, l’analyse des sédiments du lac révéla leur contamination par des pesticides organochlorés, notamment le DDT et son produit de dégradation, le DDE (dichlorodiphényldichloréthylène). Les recherches montrèrent que le DDE se trouvait à des niveaux 10 à 20 fois plus élevés dans le sang des alligators de ce lac que dans celui des animaux des lacs voisins. Cette forte concentration sanguine de DDE a provoqué une diminution de la concentration de testostérone à l’origine de la diminution de la taille du pénis et des anomalies des testicules.
Le second exemple concerne les oiseaux et est cette fois lié à une perturbation plus globale. Selon différents auteurs, le DDT est en partie responsable du déclin sévère des populations européennes et nord-américaines d’oiseaux piscivores (mangeurs de poissons) et des oiseaux de proie, résultat d’un amincissement de la coquille des œufs (Hickey, 1968 ; Ratcliffe, 1970 ; Peakall, 1970). En effet, le DDT, ingéré à travers la consommation de proies (poissons, oiseaux, rongeurs), empêche la formation normale de la coquille d’œuf. Celle-ci est parfois si fine qu’elle se casse lors de la couvée.
Bien qu’interdit depuis les années 1970 dans les pays occidentaux, on retrouve encore aujourd’hui du DDT dans les sols et les eaux du fait de sa faible biodégradabilité.
5. EFFETS DES PE SUR LE TRANSPORT DES HORMONES
Le signal véhiculé par les hormones est codé en concentration d’hormones. La manière dont circule une hormone dépend de sa nature chimique. Une hormone hydrophobe (c’est-à-dire insoluble dans les solvants polaires comme les milieux aqueux) ne peut pas circuler librement dans le sang. Par exemple, les hormones stéroïdiennes (dont les hormones sexuelles comme la testostérone et l’œstradiol) et les hormones thyroïdiennes (T3 et T4) sont hydrophobes. Pour circuler dans le sang, elles doivent donc s’associer à des protéines de transport (également appelées « carriers ») telles que la transthyrétine (protéine de transport des hormones thyroïdiennes) ou la SHGB (Sex Hormone Binding Globulin).
L’effet physiologique des hormones dépend de la concentration d’hormone libre et non de la concentration totale des hormones car seule l’hormone libre peut sortir des capillaires (petits vaisseaux) et agir sur les tissus cibles. Les hormones ne sont pas sécrétées à des taux constants. Ainsi, la liaison des hormones à des transporteurs peut contribuer à maintenir l’homéostasie (équilibre) du système endocrinien.
Or, les PE peuvent interférer sur la liaison hormone-transporteur, en se plaçant au niveau du transporteur à la place de l’hormone naturelle. Par exemple, les PCB peuvent entrer en compétition avec les hormones thyroïdiennes vis à vis de la transthyrétine chez le rat contribuant à augmenter la concentration d’hormones thyroïdiennes libres dans le système circulatoire.
6. EFFETS DES PE SUR LA LIAISON ENTRE LES HORMONES ET LEURS RÉCEPTEURS CELLULAIRES
6.1 Quand les perturbateurs endocriniens se font passer pour des hormones…
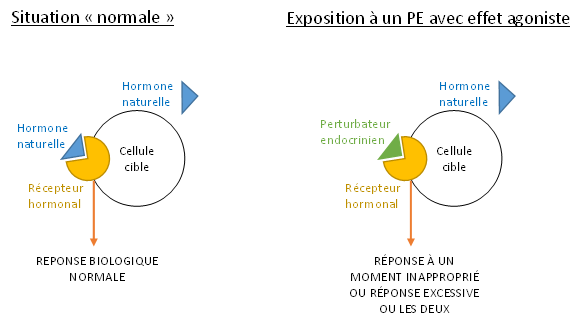
Les PE peuvent imiter les hormones naturelles et venir se fixer sur leurs récepteurs cellulaires. Même si nous avons vu que les PE pouvaient agir à différents niveaux, cette liaison aux récepteurs cellulaires des hormones est le mécanisme d’action le plus fréquent. De par cette liaison, les PE peuvent réguler l’expression de gènes cibles soit en les activant (on parle d’effets agonistes), soit en les inactivant (effets antagonistes).
Qu’est-ce que l’expression des gènes ?
L’expression des gènes, également appelée expression génique, désigne l’ensemble des processus par lesquels l’information stockée dans un gène est transcrite en ARN, puis traduite en protéines. Ces protéines ont un rôle prépondérant dans le fonctionnement de l’organisme.
6.2 Les effets agonistes (ou « effets mimétiques »)
Un PE peut mimer l’activité biologique d’une hormone naturelle. Dans ce cas, sa liaison à un récepteur cellulaire engendre une activation de celui-ci, conduisant à une réponse biologique inappropriée (ex. : production d’une protéine au mauvais moment ou en excès) (cf. figure 12).
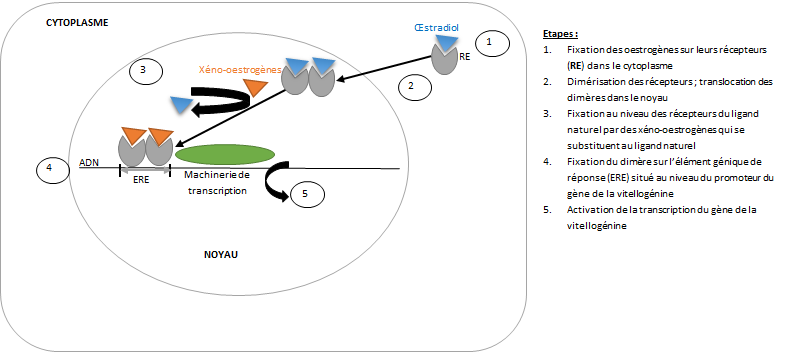
Exemple 1 : augmentation de la synthèse de vitellogénine dans des poissons en aval de stations d’épuration
La vitellogénine est une protéine à l’origine de la constitution des réserves nutritives chez les vertébrés ovipares. Sa synthèse est réalisée dans le foie, sous le contrôle de l’hormone œstradiol. La vitellogénine est transportée par le sang jusqu’aux ovaires où elle s’accumule dans les œufs.
Dans les cours d’eau, on retrouve à l’état de traces des molécules mimant les hormones œstrogènes (on parle de xéno-estrogènes ou oestrogènes étrangers) telles que des pesticides organochlorés, des plastifiants (ex. bisphénol A) et des produits pharmaceutiques dont l’éthinyl-oestradiol (EE2), principe actif de la pilule contraceptive. La concentration de ces contaminants est généralement supérieure en aval immédiat des rejets de stations d’épuration. Les caractères œstrogéniques de certains effluents britanniques ont été étudiés. L’exposition des poissons mâles à des xéno-estrogènes entraine la synthèse de vitellogénine à un degré comparable à celui des femelles (cf. figure 13). Dans cette étude britannique, les eaux usées britanniques se révèlent être la principale source de contamination œstrogénique (Purdom et al, 1994).
Toujours en Grande-Bretagne, des effets oestrogéniques liés à des xéno-oestrogènes ont été démontrés sur une population de flets communs (Platichthys flesus) avec une augmentation de 4 à 6 fois de la concentration de vitellogénine par rapport aux contrôles et la présence d’intersex (oocytes imbriqués dans les testicules) (Allen et al, 1999). Enfin, des cas de féminisation de poissons téléostéens ont également été rapportés dans la Seine (Minier et al, 2000).
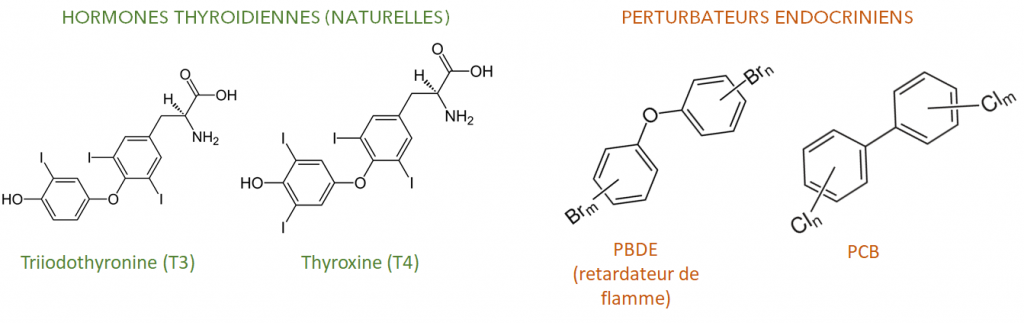
Exemple 2 : perturbation de l’activité thyroïdienne par des retardateurs de flamme et des PCB
Les molécules de la famille chimique des PBDE (utilisés comme retardateurs de flamme) et des PCB ont une structure proche de celle des hormones thyroïdiennes (cf. figure 14), ce qui leur permet de se fixer aux récepteurs cellulaires de ces dernières. Plusieurs études font notamment état d’effets agonistes de substances de ces deux familles vis-à-vis de l’activité thyroïdienne* (Ren et al, 2013 ; Gauger et al, 2007).
Or, les hormones thyroïdiennes jouent un rôle central dans la croissance et le développement de l’organisme, en particulier pour le système nerveux central, le squelette (chez les vertébrés) et la métamorphose (chez les amphibiens et les poissons). À divers degrés, elles régulent également le métabolisme des protéines, des lipides et des glucides.
Ainsi, lorsque des PE se fixent sur les récepteurs de ces hormones thyroïdiennes, ils provoquent des anomalies de la croissance, du développement du système nerveux, du comportement, et sont aussi susceptibles d’être à l’origine de problèmes métaboliques.
*Certains PBDE et certains PCB ont également des effets antagonistes sur l’activité thyroïdienne.
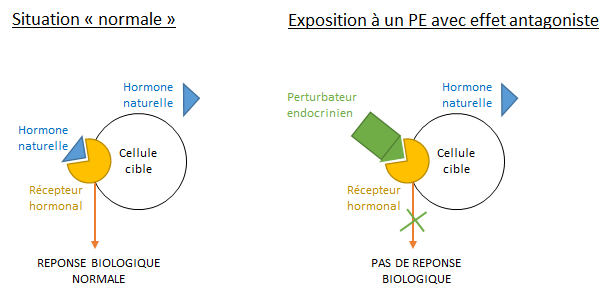
6.3 Les effets antagonistes (ou « effets de blocage »)
Les PE peuvent aussi se fixer sur les récepteurs sans les activer, empêchant la vraie hormone d’agir : ils inhibent ainsi la réponse de la cellule cible ainsi que la réponse physiologique associée. Le PE se comporte comme une « fausse clé défectueuse » (cf. figure 15).
Exemple : inhibition de la synthèse de testostérone chez des rats exposés à des plastifiants
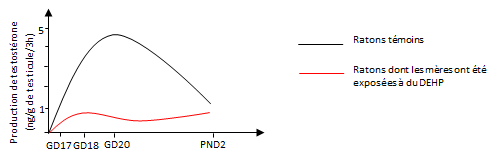
Les phtatates (DEHP par exemple) sont des produits chimiques organiques utilisés, entre autres, pour assouplir et allonger la durée de vie des plastiques. Des études menées chez le rat ont montré que les phtalates pouvaient se fixer sur les récepteurs des cellules testiculaires fœtales, et ainsi inhiber la synthèse de testostérone (cf. figure 16) (Parks et al, 2000). Ainsi, quel que soit l’âge de l’embryon, le taux de testostérone reste inférieur pour les mâles dont les mères ont été traitées aux phtalates DHEP. Alors que le taux de testostérone des mâles témoins atteint un pic au vingtième jour de la gestation, celui des mâles dont la mère a été traitée reste constant (figure 16).
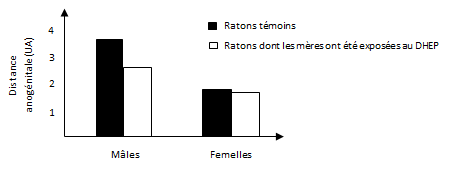
Cette diminution de la production de testostérone, qui peut être qualifiée d’effet anti-androgénique, engendre une diminution de la distance ano-génitale chez les ratons mâles, qui se rapproche de celle des femelles (cf. figure 17). Cet effet peut dont être vu comme une « féminisation ».
7. EFFETS DES PE SUR L’ÉLIMINATION DES HORMONES (CATABOLISME)
Diverses enzymes de l’organisme dégradent les hormones. L’efficacité de ces systèmes est variable, et peut être affectée par un PE. Un PE ralentissant la dégradation d’une hormone augmente la concentration ou la durée d’action de l’hormone, et ce faisant, peut augmenter ou prolonger l’effet associé.
Par exemple, certains métabolites (produits de dégradation) des PCB inhibent les enzymes qui inactivent l’hormone naturelle œstradiol. Ces métabolites ont donc un effet féminisant en augmentant la quantité d’œstradiol présente dans le sang de l’organisme exposé.
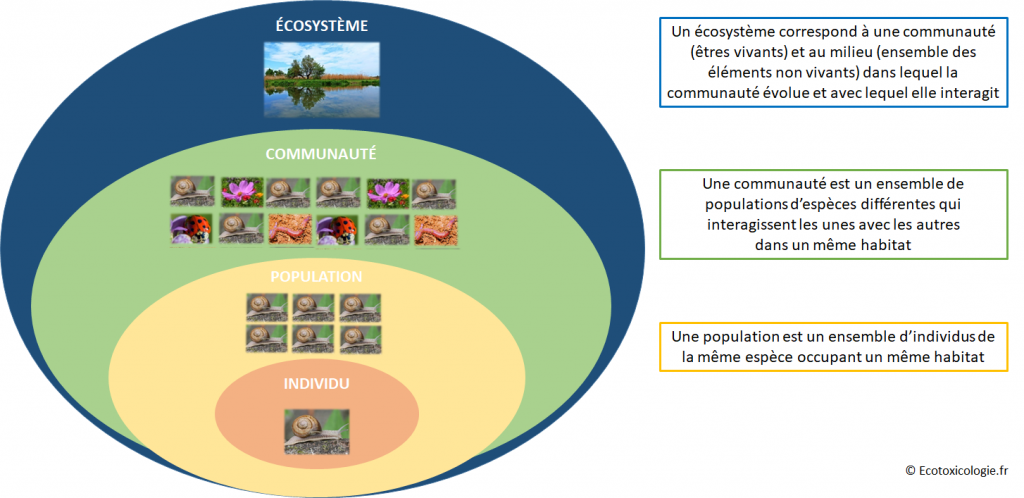
8. DE L’EFFET SUR UN ORGANISME AU DÉSÉQUILIBRE D’UN ÉCOSYSTÈME
Nous avons vu que les PE pouvaient affecter les individus et les populations associées. Au-delà, les PE peuvent fragiliser l’équilibre des communautés biologiques, avec des répercussions potentielles sur la diversité des espèces présentes dans un écosystème (cf. figure 18).
L’exemple de l’exposition des pourpres au TBT en est une illustration (cf. figure 19). L’inhibition de l’aromatase par le TBT (échelle moléculaire), à l’origine d’une masculinisation des femelles gastéropodes (échelle individuelle) entraine progressivement une réduction de la population, laquelle va impacter l’ensemble du réseau trophique (chaine alimentaire) en favorisant certaines espèces au détriment d’autres, et par suite déséquilibrer l’écosystème local.
CONCLUSION ET PERSPECTIVES
Les PE ont des effets avérés sur l’environnement
De nombreuses substances aux effets perturbateurs endocriniens sont encore autorisées à ce jour. En outre, nombre des PE qui ont été interdits (ex. : PCB, DDT, TBT, chlordécone, etc.) sont des polluants organiques persistants et sont aujourd’hui encore présents dans les milieux terrestres et aquatiques, parfois dans des zones très éloignées de leur lieu d’émission.
Une grande partie des études qui indiquent des effets néfastes des PE sur la faune ont été menées dans des régions supposées très polluées, notamment dans des écosystèmes aquatiques où les substances persistantes s’accumulent (cf. tableau ci-après). Les études de laboratoires ont permis de réaliser des progrès dans l’établissement de relations de cause à effet. Malgré leurs limites, ces travaux mettent en lumière que la perturbation endocrinienne peut localement mettre en péril un écosystème naturel et constitue un facteur puissant de régression de la biodiversité en diminuant les effectifs des populations des espèces sensibles aux PE. En outre, les animaux vertébrés ayant les mêmes glandes endocrines que l’homme, un PE néfaste pour l’homme l’est donc aussi pour ces animaux et vice versa.
| Organisme | Lieu | Polluant(s) | Effet(s) | Référence(s) |
| Grenouille | USA | Atrazine | -Diminution du taux de testostérone -Hermaphrodisme | Hayes et al, 2003 |
| Panthère de Floride | USA | Mercure DDE PCB (Phtalates ?) | -Cryptorchidie -Diminution du nombre et de la mobilité des spermatozoïdes | Mansfield et Land, 2002 |
| Béluga | Canada | PCB | Hermaphrodisme | De guise et al, 1994 |
| Ours polaire | Russie | PCB, DDT | -Diminution du taux de testostérone -Os pénien plus petit et plus fragile -Pseudohermaphrodisme | Oskam et al, 2003 |
| Pourpre (gastéropode) | Ports | Tributylétain (TBT) | Masculinisation | Bryan et al, 1986 |
| Goéland | USA | PCB, DDT, DDE, Méthoxychlore | -Féminisation -Diminution de l’épaisseur des coquilles d’œuf | Frye et Toone, 1981 |
| Oiseaux | Royaume-Uni | Xéno-Œstrogènes | -Féminisation -Intersexualité (ovotestis) -Diminution du nombre et de la mobilité des spermatozoïdes -Induction de la vitellogénine | Jobling et al, 2002 Aravindak- shan et al., 2004 Barnhoorn et al, 2004 |
| Alligator | USA | DDE | -Développement anormal des gonades et de la stéroïdogenèse -Diminution de la taille du pénis | Guillette et al., 1994 Guillette et al., 2000 |
Des effets en mélange encore mal compris
Mieux encadrer les PE passe par une meilleure évaluation des risques associés. Bon nombre des difficultés rencontrées dans l’évaluation des risques pour la santé humaine sont également rencontrées pour les espèces sauvages. L’une d’elles réside dans la multitude des substances chimiques auxquels sont exposés les organismes. En effet, si les scientifiques commencent à mieux appréhender les effets de ces molécules prises individuellement, il est beaucoup plus difficile d’évaluer leur effet en mélange (« effet cocktail »). Cette multi-exposition rend donc complexe l’établissement d’un lien de cause à effet entre contaminants, perturbation endocrinienne et fonctions physiologiques telles que la reproduction.
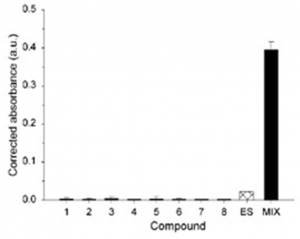
L’étude de Silva et al. (2002) illustre bien cette complexité (cf. figure 20). Les chercheurs ont mesuré l’effet de huit molécules à effet œstrogénique (huit PE) via un bioessai appelé test YES. Ce test permet d’évaluer la puissance de l’effet perturbant, qu’on nomme « potentiel œstrogénique ». Les résultats de cette étude montrent que l’effet de chacune des molécules prises séparément est pratiquement nul (« barres » 1 à 8 du graphique). Si on fait, par calcul, la somme de ces effets, on arrive à un effet, là encore, très faible (barre « ES »). En revanche, si on teste en conditions réelles le mélange de ces composés, l’effet de l’ensemble est beaucoup plus fort (barre « mix » sur le graphique). Ces résultats montrent qu’un mélange de PE peut engendrer un effet synergique, du type « 1 + 1 = 3 »
NB : on peut aussi parfois observer le phénomène inverse : les effets de plusieurs molécules peuvent s’annuler. On a ainsi un effet 1+1= 0.
Lire aussi | Les bioessais de laboratoire
De nouveaux tests pour mieux détecter les PE
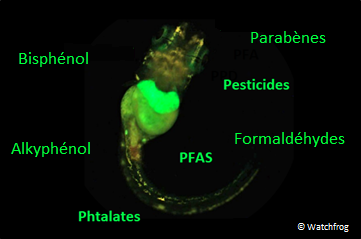
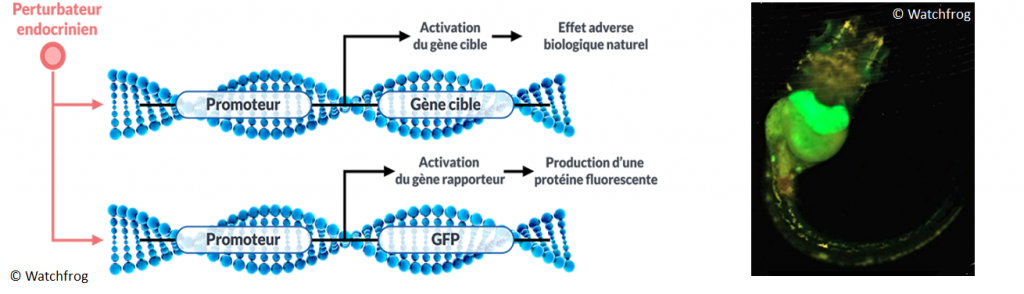
Les méthodes d’évaluation de la toxicologie réglementaire sont globalement inadaptées à la détection des PE (courbes non monotones). De nouveaux bioessais ont donc été récemment mis au point tels que le test EASZY et le test REACTIV, réalisés sur des larves de poisson transgéniques. Dans ces larves a été inséré un gène rapporteur fluorescent appelé GFP (Green Fluorescent Protein) (cf. figure 21). Grâce à ce gène rapporteur, le cerveau (test EASZY) ou le foie (test REACTIV) des embryons de poisson devient fluorescent en présence de molécules œstrogèno-mimétiques. L’intensité du signal fluorescent est proportionnelle à l’effet perturbateur. Ce test permet de détecter la nature œstrogénique de substances chimiques et de leurs métabolites (produits de transformation) avant leur mise sur le marché. Il peut aussi s’appliquer à la surveillance des milieux aquatiques (Brion et al, 2012 ; Tindall et al, 2023), via l’analyse en laboratoire d’échantillons d’eau prélevés sur site ou via le déploiement d’un dispositif in situ qui permet d’évaluer les effets PE en temps réel, à la manière d’un capteur. Des tests similaires existent pour évaluer les effets androgéniques (test RADAR) et thyroïdiens (test XETA) d’un échantillon.
Le début d’une prise de conscience politique
Pour s’attaquer au problème, l’État français a lancé en 2008 un Programme National de Recherche sur les Perturbateurs Endocriniens (PNRPE), puis une stratégie nationale sur les perturbateur endocrinien (SNPE) (Ecologie.fouv.fr, 2021). Par ailleurs, l’interdiction du Bisphénol A dans les biberons dans plusieurs pays et les différents projets de loi visant à limiter l’utilisation de certains PE prouvent que les politiques commencent à prendre conscience de ce problème.
Pour réduire le risque environnemental et sanitaire associé aux PE, il est nécessaire :
- de poursuivre la recherche : pour mieux comprendre l’effet des mélanges de PE, pour développer des méthodes permettant de détecter les effets de ces composés dans un milieu naturel, pour décrire leurs effets sur une plus grande variété d’espèces sauvages, pour mieux comprendre le fonctionnement biologique des organismes, etc.
- de mieux se coordonner au niveau international : notamment pour limiter l’utilisation ou interdire certaines substances dangereuses pour l’environnement et/ou la santé.
- d’améliorer la communication vis à vis du public : pour limiter l’utilisation de produits contenant des PE ainsi réduire l’exposition des personnes à ces substances ainsi que leur rejet dans l’environnement.

Article posté le 2 mai 2024 par Dorothée Rivet, responsable de l’UE d’écotoxicologie en L3 à l’Université Sorbonne Paris Nord de 2013 à 2023 et co-autrice du livre Ecotoxicologie paru en 2022 chez Dunod
EN SAVOIR PLUS…
– Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (Anses). Travaux et applications de l’Anses sur les perturbateurs endocriniens
– Centre intersectoriel d’analyse des perturbateurs endocriniens (CIAPE)
– Edlists.org : site répertoriant la liste des substances reconnues comme étant des perturbateurs endocriniens dans la réglementation européenne sur les produits chimiques.
– Office français de la biodiversité (OFB). Les perturbateurs endocriniens, un enjeu majeur pour l’environnement et la santé
| Ecotoxicologie.fr est entièrement gratuit et sans publicité… mais produire du contenu a un coût : soutenez-nous 🙂 |





 Il se vend près de 6 shampoings chaque seconde en France soit près de 200 millions de bouteilles par an
Il se vend près de 6 shampoings chaque seconde en France soit près de 200 millions de bouteilles par an Les produits d’entretien classiques contiennent des tensioactifs (appelés aussi agents de surface ou détergents) qui permettent d’éliminer les graisses et autres salissures à la surface de matériaux. Les détergents anioniques (charge négative) et amphotériques (dont la charge dépend du pH de l’eau) sont particulièrement présents dans les produits nettoyants, en raison de leurs propriétés nettoyantes et moussantes
Les produits d’entretien classiques contiennent des tensioactifs (appelés aussi agents de surface ou détergents) qui permettent d’éliminer les graisses et autres salissures à la surface de matériaux. Les détergents anioniques (charge négative) et amphotériques (dont la charge dépend du pH de l’eau) sont particulièrement présents dans les produits nettoyants, en raison de leurs propriétés nettoyantes et moussantes  Les phtalates, produits à quelque 6 millions de tonnes par an dans le monde
Les phtalates, produits à quelque 6 millions de tonnes par an dans le monde  20 millions de lave-linge tournent en France chaque jour en moyenne
20 millions de lave-linge tournent en France chaque jour en moyenne  La France est le 4ème consommateur mondial de médicaments : plus de 3000 médicaments à usage humain et 300 médicaments vétérinaires sont actuellement disponibles sur le marché français. Une fois que ces substances ont agi dans l’organisme, elles sont excrétées, essentiellement dans les selles et les urines, puis relarguées dans les réseaux d’eaux usées (médicaments humains) et dans les sols (médicaments vétérinaires). Une partie de ces résidus de médicaments se retrouvent donc d’une manière ou d’une autre dans le milieu aquatique. Des traces de ces composés sont d’ailleurs régulièrement détectées dans les eaux de surface et même dans les eaux de nappe
La France est le 4ème consommateur mondial de médicaments : plus de 3000 médicaments à usage humain et 300 médicaments vétérinaires sont actuellement disponibles sur le marché français. Une fois que ces substances ont agi dans l’organisme, elles sont excrétées, essentiellement dans les selles et les urines, puis relarguées dans les réseaux d’eaux usées (médicaments humains) et dans les sols (médicaments vétérinaires). Une partie de ces résidus de médicaments se retrouvent donc d’une manière ou d’une autre dans le milieu aquatique. Des traces de ces composés sont d’ailleurs régulièrement détectées dans les eaux de surface et même dans les eaux de nappe  On estime que 4000 à 6000 tonnes d’écran total sont libérées chaque année dans les zones de récifs tropicales par les 78 millions de touristes qui s’y rendent
On estime que 4000 à 6000 tonnes d’écran total sont libérées chaque année dans les zones de récifs tropicales par les 78 millions de touristes qui s’y rendent  En raison de son faible coût, l’huile de palme est, depuis quelques années, très utilisée dans l’alimentation: elle est présente dans 1 produit alimentaire empaqueté sur deux vendus en Europe (chips, biscuits, crème glacée, etc.). Or, la plantation de palmiers est à l’origine de déforestation, notamment en Indonésie. Dans ce pays, 3 millions d’hectares de forêt tropicale ont été détruits à cet effet entre 1990 et 2005 et le gouvernement prévoit un plan d’expansion des plantations de palmiers à huile de 14 millions d’hectares. La conversion des forêts en palmiers à huile a montré une perte de 80 à 100% des espèces de mammifères (dont l’orang-outan), reptiles et d’oiseaux dans ces zones
En raison de son faible coût, l’huile de palme est, depuis quelques années, très utilisée dans l’alimentation: elle est présente dans 1 produit alimentaire empaqueté sur deux vendus en Europe (chips, biscuits, crème glacée, etc.). Or, la plantation de palmiers est à l’origine de déforestation, notamment en Indonésie. Dans ce pays, 3 millions d’hectares de forêt tropicale ont été détruits à cet effet entre 1990 et 2005 et le gouvernement prévoit un plan d’expansion des plantations de palmiers à huile de 14 millions d’hectares. La conversion des forêts en palmiers à huile a montré une perte de 80 à 100% des espèces de mammifères (dont l’orang-outan), reptiles et d’oiseaux dans ces zones  Les animaux se nourrissent d’aliments (céréales, petits animaux, etc.) contenant différents polluants. Au fil du temps, ces derniers s’accumulent dans l’organisme de l’animal et en particulier dans les graisses (phénomène de bioaccumulation). Ainsi, une étude de 2010 a révélé la présence de nombreux pesticides et de PCB dans du saumon et du steak haché achetés dans des supermarchés de la région parisienne
Les animaux se nourrissent d’aliments (céréales, petits animaux, etc.) contenant différents polluants. Au fil du temps, ces derniers s’accumulent dans l’organisme de l’animal et en particulier dans les graisses (phénomène de bioaccumulation). Ainsi, une étude de 2010 a révélé la présence de nombreux pesticides et de PCB dans du saumon et du steak haché achetés dans des supermarchés de la région parisienne  Tout comme les fruits et légumes, le riz peut contenir différents polluants tels que des pesticides, en particulier s’il est issu d’une agriculture intensive classique (non « bio »). Ainsi, une étude de 2010 a révélé la présence d’isoprothiolane et de tricyclazole, 2 pesticides interdits d’usage en Europe, dans du riz acheté dans des supermarchés de la région parisienne
Tout comme les fruits et légumes, le riz peut contenir différents polluants tels que des pesticides, en particulier s’il est issu d’une agriculture intensive classique (non « bio »). Ainsi, une étude de 2010 a révélé la présence d’isoprothiolane et de tricyclazole, 2 pesticides interdits d’usage en Europe, dans du riz acheté dans des supermarchés de la région parisienne  L’eau du robinet est globalement de bonne qualité en France et les normes en vigueur sont généralement respectées
L’eau du robinet est globalement de bonne qualité en France et les normes en vigueur sont généralement respectées  Les fruits et légumes issus de l’agriculture intensive « classique » (c’est à dire non « bio ») contiennent des mélanges à faibles doses de substances chimiques classées, par les instances officielles, cancérogènes certaines, probables ou possibles ou soupçonnées d’être perturbatrices du système endocrinien. C’est ce qu’illustre notamment une étude de 2010 qui a révélé la présence de nombreux pesticides dans des produits achetés dans des supermarchés de la région parisienne
Les fruits et légumes issus de l’agriculture intensive « classique » (c’est à dire non « bio ») contiennent des mélanges à faibles doses de substances chimiques classées, par les instances officielles, cancérogènes certaines, probables ou possibles ou soupçonnées d’être perturbatrices du système endocrinien. C’est ce qu’illustre notamment une étude de 2010 qui a révélé la présence de nombreux pesticides dans des produits achetés dans des supermarchés de la région parisienne  Le lave-vaisselle est généralement moins consommateur en eau (12 L) que le lavage à la main qui dépend beaucoup du manipulateur (10 à 50 L)
Le lave-vaisselle est généralement moins consommateur en eau (12 L) que le lavage à la main qui dépend beaucoup du manipulateur (10 à 50 L)  Le liquide vaisselle est un détergent composé d’agents nettoyants appelés tensioactifs, mais aussi de colorants, conservateurs et parfums de synthèse. Bien que les tensioactifs ont l’obligation d’être biodégradables à 90%
Le liquide vaisselle est un détergent composé d’agents nettoyants appelés tensioactifs, mais aussi de colorants, conservateurs et parfums de synthèse. Bien que les tensioactifs ont l’obligation d’être biodégradables à 90%  Les composés perfluorés (PFC), tels que le téflon, ont la propriété de repousser l’eau, les matières grasses et la poussière. Ils sont ainsi utilisés comme antiadhésif dans de nombreuses poêles et casseroles. Les PFC sont persistants et s’accumulent dans les êtres vivants: certaines études ont révélé la présence de certains PFC dans les cours d’eau et les poissons (dans le foie notamment) ainsi que dans le sang humain
Les composés perfluorés (PFC), tels que le téflon, ont la propriété de repousser l’eau, les matières grasses et la poussière. Ils sont ainsi utilisés comme antiadhésif dans de nombreuses poêles et casseroles. Les PFC sont persistants et s’accumulent dans les êtres vivants: certaines études ont révélé la présence de certains PFC dans les cours d’eau et les poissons (dans le foie notamment) ainsi que dans le sang humain  3,8 millions de tonnes de bisphénol A (BPA) ont été produits en 2006
3,8 millions de tonnes de bisphénol A (BPA) ont été produits en 2006  Ces bouteilles contiennent notamment des phtalates, produits chimiques utilisés en tant que plastifiants et qui font partie de la famille des
Ces bouteilles contiennent notamment des phtalates, produits chimiques utilisés en tant que plastifiants et qui font partie de la famille des
4 commentaires
Ping :
Malfay-Regnier Christine
Article passionnant. Merci
Bernard Petit
Félicitations pour ce document de synthèse, et toutefois riche, sur les perturbateurs endocriniens.
En tant qu’ancien modeste lanceur d’alerte du bisphénol A pour un grand groupe industriel, j’apporterais seulement quelques compléments :
De nombreux signaux ont alerté sur l’effet « perturbateurs endocriniens » et pas seulement les observations écologiques des années 60-70 ainsi que l’affaire du distilbène sur la santé.
Il semble important de rappeler aussi le rôle d’Ana Soto /biologiste à Berkley qui a redécouvert, par hasard, le rôle du BPA lors de ses manips sur la recherche sur le cancer du sein à la fin des années 80. En tant qu’ingénieur de recherche dans les plastiques, c’est vers le milieu des années 90 que j’ai eu connaissance de ses travaux (voir ma note d’alerte à l’entreprise pour laquelle je travaillais : https://drive.google.com/file/d/14Bxg4wFfO0p-TcMRAgfYk43nvki1S4CT/view?usp=sharing). Elle a en effet observé l’effet oestrogéno-mimétique du BPA dans l’accélération de la reproduction de cellules cancéreuses du sein.
On pourra souligner que l’incident survenu dans ses travaux est en fait une redécouverte fortuite de l’effet oestrogéno-mimétique du BPA, découvert par Dodds et Lawson en 1938 lorsqu’ils recherchaient une molécule de synthèse pour réduire les risques de fausses couches. Ils sélectionnèrent alors le diethylstibestrol (futur distilbène), jugé plus efficace pour l‘effet oestrogènique que le BPA !
Si le bisphénol A (BPA) est maintenant interdit, grâce à la réglementation, dans les matériaux destinés au contact alimentaire depuis 2015 en France et dans quelques pays, il n’empêche qu’il existe des dizaines de molécules de type bisphénols susceptibles d’être rencontrées dans de multiples produits destinés au contact alimentaire (robots ménagers, jouets…). La réglementation n’a visé qu’une molécule alors que toute la famille des bisphénols est probablement à remettre en cause.
Aouichat Souhila
Excellent document