Les bioessais de laboratoire : évaluer la toxicité des polluants en conditions contrôlées
L’évaluation des effets des polluants sur les organismes vivants fait classiquement appel à des bioessais en laboratoire, qui permettent de mesurer la toxicité de ces substances dans des conditions contrôlées. Principes, utilisations, classification, avantages et limites de ces outils : vous saurez tout (ou presque) grâce à cet article !
I. LABORATOIRE, TERRAIN, MODÉLISATION : DES APPROCHES COMPLÉMENTAIRES EN ÉCOTOXICOLOGIE
On distingue classiquement trois grandes approches en écotoxicologie : les expérimentations de laboratoire, le terrain et la modélisation. Le mésocosme est généralement considéré comme l’intermédiaire entre le laboratoire et le terrain.
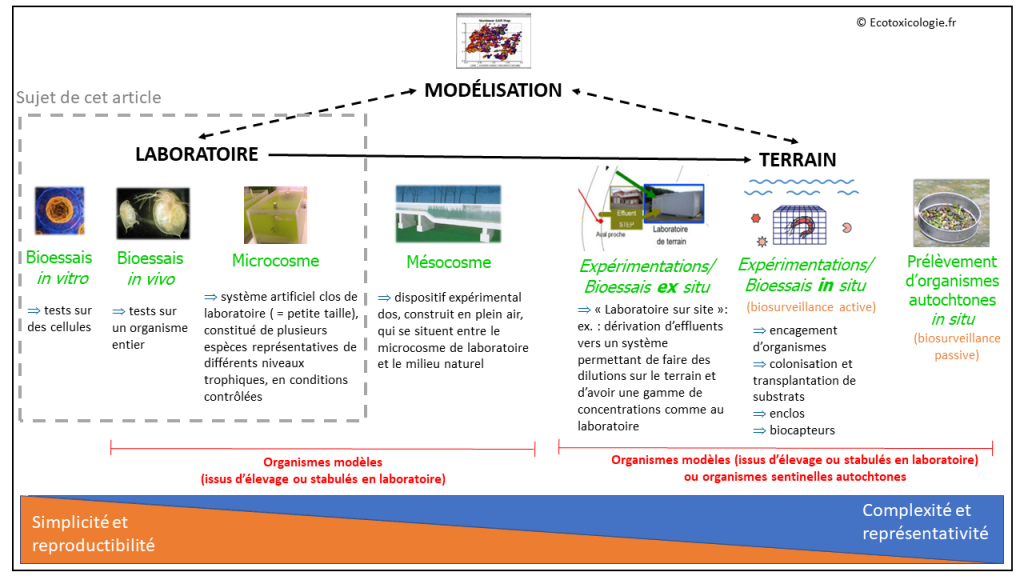
Pour des raisons pratiques, l’écotoxicologie s’est historiquement centrée sur les expérimentations de laboratoire, dans une démarche proche de la toxicologie (Pery, 2009). Ces expérimentations, qui sont l’objet de cet article, sont généralement désignées sous le nom de bioessais (terme que nous utiliserons par la suite) mais aussi de biotests ou encore de tests de toxicité en laboratoire.
Remarque : les bioessais regroupent l’ensemble des « méthodes d’analyse qui mettent en œuvre des cellules, des organismes ou des communautés pour mesurer leurs réactions aux polluants présents dans l’environnement » (Centreecotox.ch, 2018). Ils peuvent être appliqués en laboratoire (sujet de cet article) ou sur le terrain (in situ et ex situ).
Lire aussi | Évaluer les effets des polluants sur les êtres vivants et les écosystèmes : les grands principes
II. LES GRANDS PRINCIPES D’UN BIOESSAI DE LABORATOIRE
1. Qu’est-ce qu’un bioessai de laboratoire?
1.1 Principe
Un bioessai de laboratoire est un test au cours duquel un modèle vivant est exposé à un ou plusieurs polluant(s) dont on veut estimer la toxicité (ou « écotoxicité »).
Plus précisément, un bioessai de laboratoire consiste à exposer un modèle vivant (cellules, organismes ou communautés d’organismes) à une substance (ex. : un pesticide), à un mélange de substances (ex. : plusieurs pesticides) ou à un échantillon environnemental (ex. : eau de rivière, sol, air, effluent industriel, etc.), dans un milieu ( = un récipient comme un aquarium, une microplaque, un pot, etc.), en conditions contrôlées (température, taux d’oxygène, salinité, nourriture, lumière, etc.), pendant une durée déterminée, et à observer un ou plusieurs effet(s) de cette substance sur le modèle vivant étudié tels que la mortalité, la croissance, la reproduction ou les dommages à l’ADN : on parle de « critère(s) d’évaluation » ou « endpoint(s) ».
Des analyses chimiques (ex. : analyse des contaminants présents dans un échantillon environnemental) ou biochimiques (ex : réserves énergétiques et taux d’hormones des organismes modèles) sont parfois réalisées en complément pour aider à l’interprétation des résultats du bioessai.
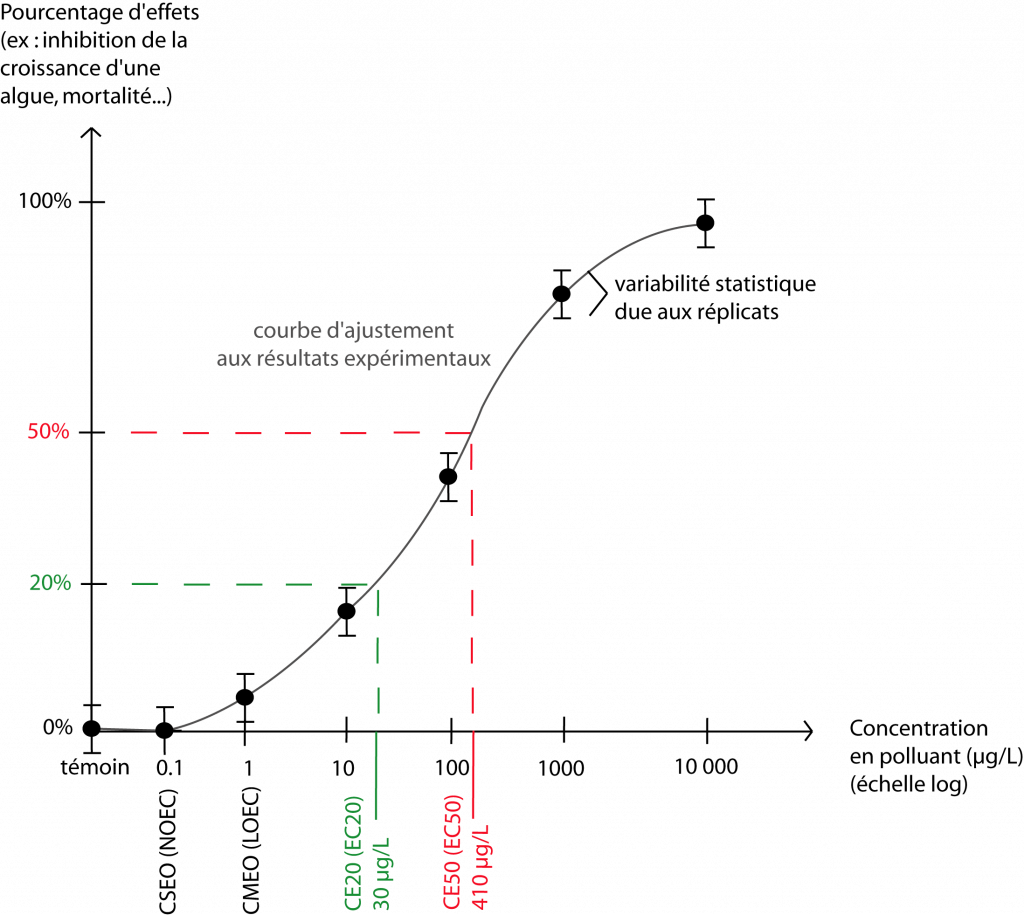
Comme l’illustre le schéma ci-dessous, le modèle vivant est exposé à différentes concentrations de la substance ou de l’échantillon environnemental étudié. Un témoin négatif (sans substance toxique)* est également nécessaire pour valider les résultats du bioessai et établir les valeurs de référence (voir plus loin). Plusieurs réplicats de chacune des concentrations testées sont requis pour garantir la précision et la fiabilité des résultats.
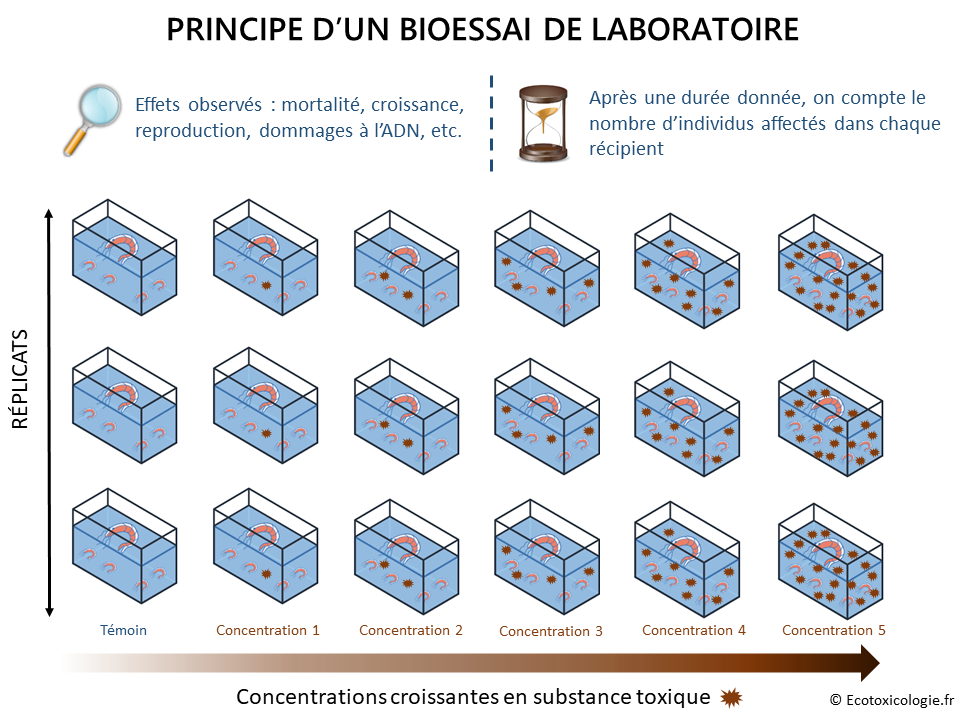
Miam !
Lors d’une expérimentation de 21 jours menée sur la daphnie (un microcrustacé d’eau douce), des chercheurs ont observé que celle-ci pondait en moyenne 159 œufs si elle était nourrie d’algues Chlorella pyrenoidosa contre seulement 23 œufs si elle était alimentée en herbes séchées et nourriture pour truite. La qualité de la nourriture proposée aux organismes modèles est donc un élément déterminant dans la réussite d’un bioessai, tout comme la qualité du milieu (qualité de l’eau ou du sol utilisé pour le test) (Stephenson et Watts, 1984).
1.2 Toxicité aigüe VS toxicité chronique
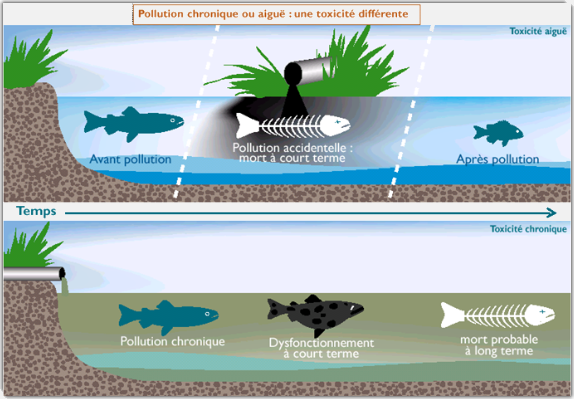
Selon la durée d’exposition, on distingue les bioessais de toxicité aigüe (exposition à une forte dose ou à une substance très toxique pendant un temps court) et les bioessais de toxicité chronique (exposition à une faible dose pendant un temps long). A noter que cette notion de temps court ou long est relative à la durée de vie de l’organisme modèle : dans le cas d’un bioessai de toxicité chronique, le temps d’exposition correspond en moyenne à 10 % de la vie de l’organisme et doit intégrer plusieurs stades de son cycle de vie (Angerville, 2009).
*Il existe parfois plusieurs types de témoins : les témoins négatifs (obligatoires), les témoins tiers-solvant (dans le cas où un solvant tel que l’éthanol est utilisé pour faciliter la solubilisation dans l’eau de la substance étudiée) et les témoins positifs (nécessaires dans le cadre de contrôles qualité).
2. L’établissement des valeurs de référence
Les résultats de ces bioessais permettent d’établir des valeurs de référence, qui caractérisent le niveau d’écotoxicité d’une substance ou d’un échantillon. Voici les plus utilisées (ac-lyon.fr, 2019 ; Dubuc, 2013) :
- la concentration sans effets observés CSEO (en anglais : NOEC) : c’est la concentration en substance/échantillon testé(e) la plus élevée pour laquelle aucun effet significativement différent du témoin n’a été observé ;
- la concentration minimale avec effets observés CMEO (en anglais : LOEC) : elle correspond à la concentration la plus faible pour laquelle un effet significativement différent du témoin a été observé.
- la concentration efficace CE50 (en anglais : EC50) : elle correspond à la concentration en substance/échantillon qui engendre un effet différent de 50 % par rapport au témoin. Pour une plante par exemple, ce peut être une croissance racinaire 50 % moins élevée que pour la plante témoin. Pour des animaux, ce peut être la mort de la moitié des organismes. La CE50 est déterminée statistiquement sur la base d’une modélisation.
3. A quoi servent ces bioessais de laboratoire ?
3.1 Évaluer le danger et le risque environnemental d’une substance
Les bioessais de laboratoire sont parfaitement adaptés à l’évaluation de la toxicité (ou « écotoxicité ») intrinsèque d’une substance chimique. De fait, ils sont largement utilisés par la réglementation européenne, notamment pour évaluer le danger (toxicité) et le risque environnemental (Risque = Danger x Exposition) relatifs à une substance ayant fait d’objet d’une demande d’autorisation de mise sur le marché (pesticide, détergent, médicament, etc.).
L’évaluation du risque est basée sur l’utilisation des valeurs de références décrites plus haut. Celles-ci permettent de calculer, pour une substance donnée, deux types de valeurs seuils « à ne pas dépasser » dans le milieu naturel pour garantir la protection de l’environnement et de la santé humaine : la PNEC (Predicted no effect concentration) préconisée par les guides techniques européens (en appui notamment au règlement REACH) et la NQE (Norme de Qualité Environnementale) introduite par la Directrice européenne Cadre sur l’Eau (DCE).
La comparaison de ces valeurs seuils avec les concentrations prédites ou mesurées dans le milieu naturel permet d’évaluer le risque environnemental lié à la substance chimique étudiée. Cette démarche présente néanmoins plusieurs limites importantes, parmi lesquelles :
- le faible réalisme environnemental des bioessais de laboratoire, lié à l’utilisation d’organismes d’élevage et aux conditions contrôlées qui sont très différentes des conditions de terrain ;
- la non prise en compte des interactions avec les autres contaminants présents dans le milieu (« effet cocktail »).
Les bases de données écotoxicologiques
Il existe de nombreuses bases de données internationales compilant en libre accès des informations sur la toxicité des substances chimiques vis-à-vis des organismes vivants. Citons par exemple la base de l’ECHA (Agence européenne des produits chimiques), la base ECOTOX de l’US EPA ou encore le eChemPortal de l’OCDE.
Lire aussi | Méthode d’évaluation du risque environnemental lié à un polluant
3.2 Contrôler les rejets polluants
Il est désormais admis que le contenu chimique d’un échantillon ne renseigne pas, de façon systématique, sur sa toxicité vis-à-vis d’organismes vivants. Il est également reconnu que les actions combinées liées à la présence de mélanges de polluants ne peuvent pas être prévues à partir d’une liste de ces polluants (Angerville, 2009) .
L’application de bioessais de laboratoire sur des matrices complexes liquides ou solides tels que des effluents, des déchets ou des sols pollués peut donc fournir des informations complémentaires aux analyses physico-chimiques et surtout plus globales, permettant d’évaluer leur impact potentiel sur le milieu. En France, le bioessai d’inhibition de la mobilité de la daphnie est intégré dans le calcul des redevances payées par les industriels aux Agences de l’Eau. Des réflexions sont également en cours pour imposer la réalisation de bioessais dans le cadre d’épandage de matières fertilisantes (lisiers, fumiers, boues de station d’épuration et composts).
3.3 Des outils au service de la recherche
Outre ces applications réglementaires, les bioessais de laboratoire sont largement utilisés dans le domaine de la recherche scientifique pour étudier les mécanismes d’action des polluants, analyser les interactions de différentes sources de stress environnementaux, comprendre les réponses d’un organisme face à un toxique (adaptations physiologiques, développement d’une tolérance, etc.) ou mesurer les phénomènes de bioaccumulation des polluants (Angerville, 2009).
L’approche EDA (Effect-directed analysis) pour identifier les substances responsables d’un effet toxique
Les bioessais appliqués sur un échantillon environnemental ne permettent pas d’identifier la ou les substance(s) à l’origine d’un éventuel effet toxique observé. L’approche EDA, développée actuellement dans les laboratoires de recherche, tente de pallier cette limite. Elle consiste à soumettre l’échantillon à une succession de fractionnements chimiques et à évaluer la toxicité de chacune des fractions obtenues à l’aide de bioessais. In fine, la ou les fractions identifiées comme toxiques font l’objet d’analyses chimiques permettant d’identifier les substances responsables de l’effet observé (PIREN-Seine, 2011).
III. LES DIFFÉRENTS TYPES DE BIOESSAIS DE LABORATOIRE
1. Plusieurs critères de classification
Il existe une multitude de bioessais de laboratoire, pouvant être catégorisés selon différents critères :
| CRITÈRE | CATÉGORIES DE BIOESSAIS | EXEMPLES DE BIOESSAIS DE LABORATOIRE |
| Normalisation | Bioessais normalisés | -Essai d’inhibition de la mobilité de Daphnia magna (ISO 6341, OCDE 202) -Test d’Ames (ISO 16240) |
| Bioessais non normalisés | -De nombreux bioessais expérimentaux appliqués dans des laboratoires de recherche (ex. : essai non normalisé sur la reproduction d’un mollusque d’eau douce) | |
| Nature du modèle vivant | Bioessais in vitro (modèle cellulaire) | -Le test YES (cellules de levure de boulanger Saccharomyces cerevisiae génétiquement modifiées) -Le test ER-Calux (cellules humaines) |
| Bioessais in vivo ou in toto (organisme entier) | -Essais de toxicité sur crustacés (Daphnia magna), algues vertes (Raphidocelis subcapicata) ou vers de terre (Eisenia fetida) ou bactérie (Vibrio fischeri) | |
| Microcosmes (« bioessais plurispécifiques ») | -Aquarium contenant des organismes de différents niveaux trophiques (ex : algues, microcrustacés et poissons) | |
| Compartiment de vie de l’organisme modèle | Aquatique | -Essai de survie du poisson zèbre (Danio rerio) |
| Terrestre | -Essai sur la germination et les premiers stades de croissance des végétaux supérieurs -Essai de toxicité chronique sur les abeilles domestiques par voie orale | |
| Durée d’exposition | Bioessais de toxicité aigüe (temps « court ») | -Essai d’inhibition de la mobilité de Daphnia magna (24h ou 48 h) -Essai d’évitement des vers de terre Eisenia fetida (48 h) |
| Bioessais de toxicité chronique (temps « long ») | -Essai de reproduction de Daphnia magna Strauss (21 jours) -Essai de reproduction des vers de terre Eisenia fetida (8 semaines) | |
| Type d’effet étudié (qui dépend en partie de la durée et de la dose d’exposition) | Létalité (mort) ou grave trouble physiologique | -Essai d’inhibition de la mobilité de Daphnia magna |
| Effet reprotoxique (perturbation de la reproduction ou effets sur la descendance) | -Essai de reproduction des vers de terre Eisenia fetida | |
| Effet génotoxique ou mutagène (dommages à l’ADN) | -Test des comètes | |
| Perturbation endocrinienne | -Test YES | |
| … | … |
Quelles sont les caractéristiques d’un bioessai « idéal » ?
D’après Calow (1993), un « bon » bioessai de laboratoire doit respecter la règle des 5 R (en anglais) :
–Relevance : ce qui signifie réalisme, pertinence, représentativité. Le modèle vivant choisi pour le test doit être représentatif du milieu étudié (exemple : un ver de terre lorsqu’on étudie les impacts d’une substance sur le sol).
–Reliability : fiabilité. Une méthode qui peut être utilisée à n’importe quel moment.
–Repeatability : répétabilité. Lorsque le test est répété, il doit donner des résultats qui varient peu.
–Reproducibility : reproductibilité. Si différents laboratoires à travers le monde réalisent le biossai sur une même substance, ils doivent obtenir des résultats voisins.
–Robustness : robustesse. La méthodologie du bioessai doit pouvoir être appliquée par n’importe quel technicien moyennement entraîné ou formé.
2. Les kits de tests prêts à l’emploi
La mise en place d’élevage(s) ou de culture(s) en continu pour disposer à tout moment des organismes modèles en qualité et en quantité suffisantes pour les bioessais n’est pas toujours réalisable faute de place, d’installations adaptées et/ou de personnel.
Pour remédier à ce problème, certains bioessais sont disponibles dans le commerce sous forme de kits « prêts à l’emploi » basés sur une miniaturisation et une standardisation des essais de toxicité classiques (Angerville, 2009). . Ces kits contiennent notamment les organismes tests, qui peuvent par exemple être sous forme d’œufs de dormance dans le cas des daphnies (sporocystes). Cette forme de commercialisation présente l’avantage de libérer l’utilisateur des contraintes de l’élevage et de la culture. Elle permet également de disposer facilement d’une variété de bioessais qui peuvent servir à constituer une batterie minimale de tests pour caractériser l’écotoxicité d’un échantillon.
3. L’intérêt d’appliquer une batterie de bioessais
Chaque organisme présente ses propres sensibilités vis-à-vis d’une substance chimique donnée. De fait, les bioessais de laboratoire sont le plus souvent associés pour former une batterie de tests, comme l’illustre l’exemple de l’étude de l’écotoxicité d’un effluent hospitalier présenté ci-dessous.
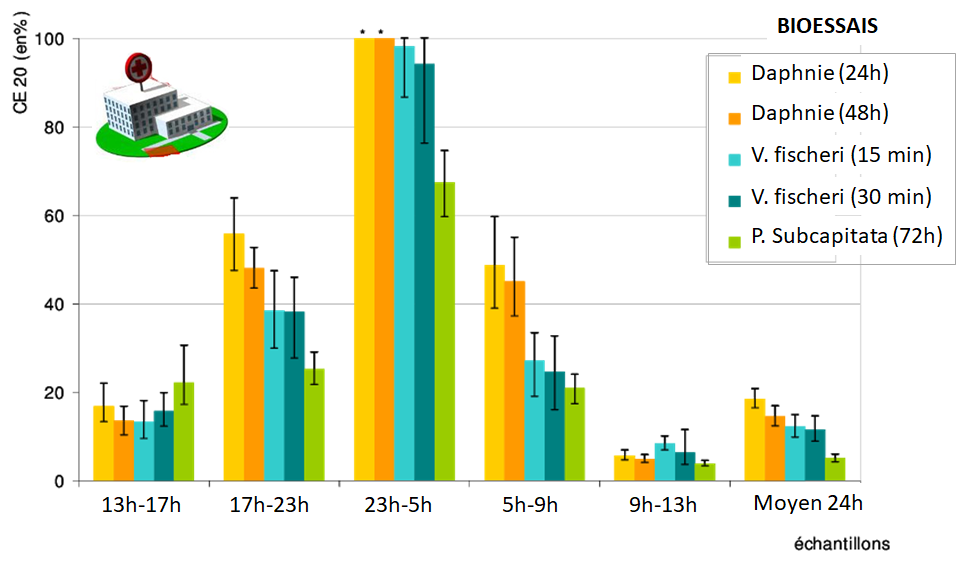
Dans le cadre d’une évaluation du risque environnemental lié à une substance chimique, on utilise généralement des bioessais basés sur des espèces modèles représentatives de plusieurs niveaux trophiques (= plusieurs niveaux de la chaîne alimentaire) d’un écosystème considéré. Par exemple, pour étudier les effets d’un polluant sur les rivières, on pourra associer des bioessais sur des algues, des daphnies et des poissons. Sur les bases des résultats obtenus, on retiendra la concentration d’effet (CE50 ou CSEO) la plus basse des bioessais mise en œuvre, correspondant à l’espèce la plus sensible.
En alternative ou en complément d’une batterie de bioessais, il est possible de réaliser une étude en microcosme : on parle de « bioessai plurispécifique » (= plusieurs espèces). Si on reprend l’exemple précédent de la rivière, il peut s’agir d’un aquarium test contenant des algues, des daphnies et des poissons.
IV. ZOOM SUR QUELQUES BIOESSAIS DE LABORATOIRE
1. Exemples de bioessais in vivo (organismes entiers)
1.1 Essai de bioluminescence bactérienne
| Modèle vivant | Compartiment de vie | Durée d’exposition | Effet étudié | Norme | En savoir plus |
| Bactérie Vibrio fischeri | Aquatique (bactérie marine) | 5, 15 et 30 min (toxicité aigüe) | Inhibition de la bioluminescence bactérienne | ISO 11348 (2009) | Centre Ecotox |
Vibrio fischeri est une bactérie marine dont le métabolisme cellulaire produit de la lumière : on parle de bioluminescence. Ce bioessai parfois nommé Microtox, est basé sur la mesure de l’inhibition de cette bioluminescence par la(les) substance(s) chimique(s) étudiée(s) (Liec.univ-lorraine.fr, 2021a). Il permet une évaluation rapide de l’écotoxicité générale et est fréquemment utilisé pour l’étude des effluents de station d’épuration, notamment en Allemagne où il fait partie des paramètres réglementaires de contrôle des rejets d’eaux usées (Centreecotox.ch, 2021a).
1.2 Essai d’inhibition de la croissance d’une algue d’eau douce
| Modèle vivant | Compartiment de vie | Durée d’exposition | Effet étudié | Norme | En savoir plus |
| Algue verte unicellulaire (Raphidocelis subcapitata, anciennement nommée Pseudorella subcapitata) | Aquatique (eau douce) | 72 h (toxicité chronique) | Inhibition de la croissance | ISO 8692 (2012) | LIEC (Université de Lorraine) |
Ce bioessai consiste à évaluer l’inhibition de la croissance d’algues vertes unicellulaires induite par l’exposition à une substance chimique, sur plusieurs générations. En pratique, des algues sont mises au contact de différentes concentrations d’un échantillon à tester durant 72h à 23°C, en présence d’un milieu nutritif et sous illumination constante (pour permettre la photosynthèse). Un pourcentage d’inhibition de la croissance est déterminé pour chaque condition, par comparaison aux témoins négatifs (Liec.univ-lorraine.fr, 2021a).

1.3 Essai d’inhibition de la mobilité de la daphnie
| Modèle vivant | Compartiment de vie | Durée d’exposition | Effet étudié | Norme | En savoir plus |
| Microcrustacé (Daphnia magna) | Aquatique (eau douce) | 24 ou 48 h (toxicité aigüe) | Immobilisation | ISO 6341 / OCDE 202 | LIEC (Université de Lorraine) |
Les daphnies sont des organismes zooplanctoniques des eaux stagnantes largement répandus dans les milieux tempérés. Elles se nourrissent d’algues et peuvent constituer une source d’alimentation pour les poissons. La daphnie est LE modèle biologique standard pour l’étude de l’écotoxicité aigüe des substances chimiques et des échantillons d’eau.
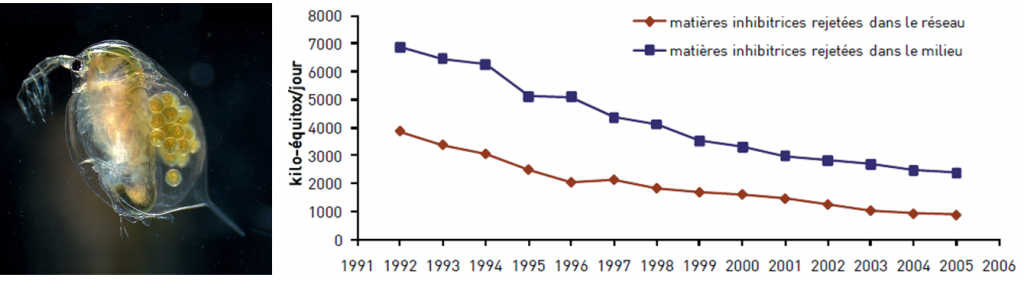
Le principe de ce bioessai est d’exposer des daphnies juvéniles (âgées de moins de 24h) à une gamme de concentrations en polluant, puis à observer l’inhibition de leur nage après 24 et/ou 48 h. Sensible, reproductible et relativement simple de mise en œuvre, ce test est utilisé depuis le milieu des années 1970 pour le calcul des redevances des Agences de l’Eau (paramètre « matières inhibitrices »). Son application sur les effluents des industriels du bassin Seine-Normandie (voir graphique ci-dessous) permet de mettre en évidence une baisse des flux de matières toxiques rejetées dans le réseau d’assainissement public et dans le milieu naturel entre 1992 et 2005 (PIREN-Seine, 2011).
1.4 Essai non normalisé sur la reproduction d’un mollusque d’eau douce
| Modèle vivant | Compartiment de vie | Durée d’exposition | Effet étudié | Norme | En savoir plus |
| Mollusque (Potamopyrgus antipodarum) | Aquatique (eaux douces et saumâtres) | 9 semaines (toxicité chronique) | Reproduction (nombre d’embryons produits) | Essai non normalisé | Thèse de Marion Gust (INRAE, 2010) |

De nombreux bioessais ne sont pas normalisés et ne sont donc pas utilisables dans un cadre réglementaire. C’est le cas de l’essai de reproduction de Potamopyrgus antipodarum décrit ici. Ce mollusque est une espèce largement utilisée dans des travaux de recherche, et ce pour plusieurs raisons (Gust, 2010) :
- il est répandu dans un grand nombre d’habitats d’eau douce et saumâtre ;
- c’est une espèce euryèce, c’est à dire tolérante à de nombreux stress : température, teneur en oxygène, taux de matière organique, etc. ;
- il est facile à élever et à transporter ;
- la quasi-totalité des individus européens sont des femelles, qui se reproduisent par parthénogenèse : pas besoin d’accouplement et faible variabilité biologique ;
- il est très sensible aux perturbateurs endocriniens (Bisphénol A, octylphénols, tributylétain, etc.).
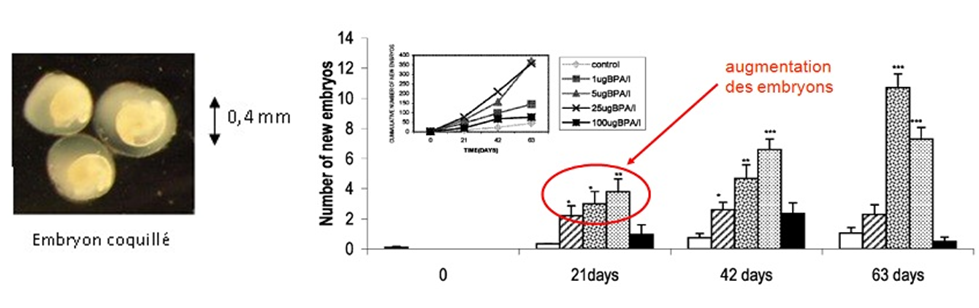
Dans une expérimentation menée par Jobling et al. en 2004, cet organisme a été utilisé pour étudier les effets reprotoxiques (effets sur la reproduction) du très controversé Bisphénol A (BPA). Celle-ci a consisté à disposer des mollusques dans des béchers (pots en verre) contenant de l’eau, de la nourriture et différentes concentrations de BPA, représentatives des concentrations généralement relevées dans le milieu naturel. A 3, 6 et 9 semaines, la survie et la reproduction (comptage du nombre d’embryons présents dans chacun des mollusques) ont été mesurées dans chacun des béchers, révélant une augmentation de la production d’embryons dès 5 µg BPA par litre d’eau.
1.5 Essai de survie du poisson zèbre
| Modèle vivant | Compartiment de vie | Durée d’exposition | Effet étudié | Norme | En savoir plus |
| Poisson zèbre (Danio rerio) | Aquatique (eau douce) | 96 h (toxicité aigüe) | Mortalité | ISO 7346 (1996) | Ineris (2003) |

Le poisson zèbre est un petit poisson tropical d’eau douce très apprécié par les aquariophiles pour sa robustesse et sa facilité d’élevage. Il est couramment utilisé comme modèle vertébré dans les domaines de la recherche toxicologique, écotoxicologique, pharmacologique, de la biologie du développement et de la génétique (Perrichon, 2014).
Ce bioessai de toxicité aigüe consiste à mesurer l’effet d’une substance chimique sur la survie du poisson après 96 h d’exposition.
1.6 Essai sur la germination et les premiers stades de croissance des végétaux supérieurs

| Modèle vivant | Compartiment de vie | Durée d’exposition | Effet étudié | Norme | En savoir plus |
| Les plantes Sorghum saccharatum (sorgo commun), Lepidium sativum (cresson) et Sinapis alba (moutarde blanche) | Terrestre (sol) | 72 h | Inhibition de la germination des semences et de la croissance (racines et pousses) | ISO 18763 (2016) | ISO.org |
Les bioessais sur les sols (par exemple après réhabilitation d’un site industriel) ou sur les matières destinées à être épandues (lisier, fumier, compost, boues de station d’épuration, etc.) sont nécessaires pour évaluer le risque environnemental potentiel. Cet essai de germination et de croissance, à la fois très pratique et rapide, a été développé à cet effet (ISO 18763:2016).
Il est réalisé dans des plaques d’essai transparentes incubées à la verticale, afin de pouvoir observer les racines et les pousses des semences ayant germé. À l’issue d’une période d’exposition de 72 h, les plaques sont photographiées et une analyse d’images est effectuée pour déterminer divers critères d’effets tels que le pourcentage de germination des semences et la longueur des racines et des pousses. Pour tenir compte de la sensibilité variable des espèces végétales, les essais sont réalisés avec les semences de trois espèces végétales.
1.7 Essai d’évitement des vers de terre
| Modèle vivant | Compartiment de vie | Durée d’exposition | Effet étudié | Norme | En savoir plus |
| Ver de terre (Eisenia fetida) | Terrestre (sol) | 48 h (toxicité aigüe) | Évitement des substances toxiques | ISO 17512-1 (2008) | Centre Ecotox (principe et vidéo) |
Les vers de terre ont un rôle essentiel dans les sols. Ils interviennent dans la structuration et l’aération des sols, les échanges gazeux, ou encore dans la circulation des liquides et la minéralisation de la matière organique. Eisenia fetida est un des modèles de vers de terre couramment utilisés en écotoxicologie, en raison de sa sensibilité aux polluants et de son cycle de vie court. Il se nourrit naturellement de compost ou de fumier.
Ce bioessai évalue l’influence des substances chimiques sur le comportement d’évitement des vers de terre exposés pendant 2 jours à un échantillon de sol naturel contaminé, ou à des concentrations connues d’une substance testée mélangée à un sol. Concrètement :
- Les containers de test sont divisés en deux parties : une première partie pour l’échantillon de sol contaminé et une seconde pour l’échantillon de sol témoin (non contaminé).
- Les vers adultes sont introduits dans les containers au niveau de la ligne médiane séparant le sol contaminé et le sol non contaminé.
- Les containers sont fermés à l’aide d’un filet et d’un couvercle percé.
- Après 48 h, les vers de terre se trouvant dans chacune des deux parties sont recherchés et comptés.

A noter qu’un autre test utilisant Eisenia fetida pourrait prochainement être intégré dans les paramètres de contrôle des matières fertilisantes destinées à l’épandage agricole (l’essai de reproduction sur 8 semaines – ISO 11268-2).
1.8 Essai de toxicité chronique sur l’abeille domestique par voie orale
| Modèle vivant | Compartiment de vie | Durée d’exposition | Effet étudié | Norme | En savoir plus |
| Abeille domestique (Apis mellifera L.) | Terrestre / Aérien | 10 jours (toxicité chronique) | Mortalité | OCDE 245 (2017) | OCDE |

Les pollinisateurs tels que les abeilles domestiques peuvent être exposés à des résidus de pesticides ou d’autres produits chimiques pendant une période prolongée, soit par le biais d’aliments contaminés, stockés et consommés par les abeilles dans la ruche, soit par la recherche de nourriture dans des zones contaminées. Pour étudier ce risque potentiel, une étude de toxicité chronique (long terme) peut être menée en laboratoire en exposant pendant 10 jours des jeunes abeilles adultes à des aliments (solution de saccharose) dans lesquels a été incorporé le produit à tester.
2. Exemple d’un bioessai in vitro (modèle cellulaire) : le test YES
| Modèle vivant | Durée d’exposition | Effet étudié | Norme | En savoir plus |
| Levure de boulanger (Saccharomyces cerevisiae) génétiquement modifiée | 18 h | Activation ou inhibition du récepteur humain des œstrogènes | ISO 19040-1 (2018) | Centre Ecotox : fiche protocole et vidéo |
Parmi les multiples polluants, nombreux sont qualifiés de « perturbateurs endocriniens » en raison de leur capacité à altérer le fonctionnement normal du système endocrinien (système hormonal) et à engendrer des effets sur la reproduction, le développement ou l’homéostasie (équilibre) d’un organisme ou de sa descendance (Aït-Aïssa, 2018).
Les substances à activité œstrogéniques telles que l’éthinyl-oestradiol (hormone de la pilule contraceptive) font partie de ces perturbateurs endocriniens et peuvent agir sur les organismes vivants à des concentrations quasiment indétectables par analyse chimique. Les bioessais in vitro constituent alors une solution intéressante pour détecter ces polluants et pour mesurer l’activité œstrogénique globale de toutes les substances actives présentes dans un échantillon (ex. : échantillon d’eau de rivière) (Centreecotox.ch, 2021b).

Au niveau moléculaire et cellulaire, la perturbation endocrinienne implique différents mécanismes d’action. Parmi eux, l’interaction des substances chimiques avec les récepteurs nucléaires (récepteurs présents sur les noyaux de la cellule) joue un rôle central dans l’apparition des effets néfastes pour les organismes. Dans l’environnement aquatique, la présence de substances capables d’interagir avec le récepteur des œstrogènes (ER) a ainsi été associée au phénomène de féminisation de poissons, avec des répercutions à l’échelle de la population (Aït-Aïssa, 2018) .
Le test YES (Yeast Estrogen Screen) permet de mettre en lumière l’activation ou l’inhibition de ce récepteur ER par une ou plusieurs substance(s) chimique(s) testée(s). Il s’appuie sur l’utilisation de cellules de levures de boulanger génétiquement modifiées pour induire une réaction colorée en cas de fixation d’une substance à effet œstrogénique au récepteur ER.
3. Exemple d’un bioessai de génotoxicité : le test des comètes
| Modèle vivant | Compartiment de vie | Durée d’exposition | Effet étudié | Norme | En savoir plus |
| Cellules, ou organisme dans lequel sont prélevées les cellules après exposition | Test pouvant s’appliquer à des organismes aquatiques ou terrestres | Dépend de l’organisme testé | Cassures de l’ADN | OCDE 489 (2016), pour une application sur des cellules de mammifères | Thèse de Sébastien Lemiere (Université de Lorraine, 2004) |
Les chercheurs estiment qu’environ un tiers des substances chimiques susceptibles d’atteindre les écosystèmes aquatiques présentent un potentiel génotoxique, c’est-à-dire une capacité à générer des effets directs et indirects sur l’ADN des cellules exposées. Or, l’atteinte de l’ADN peut avoir des conséquences particulièrement dramatiques pour les organismes vivants, telles que l’initiation de la cancérogenèse (cancers) et la génération d’effets héréditaires via des mutations sur les cellules germinales (cellules à l’origine des gamètes). Des éléments essentiels à la pérennité de l’espèce peuvent ainsi être affectés, tels que le succès de la reproduction et la structure génétique des populations (Devaux et Bony, 2009).
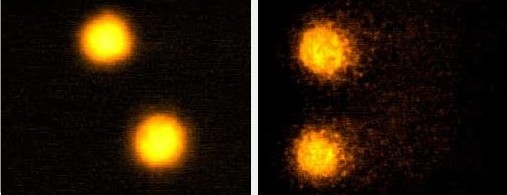
On comprend donc aisément l’intérêt de disposer d’outils permettant d’évaluer ce potentiel génotoxique. Parmi eux, le test des comètes (ou « single cell gel eletrophoresis assay ») est largement utilisé en raison de sa sensibilité, de sa rapidité de mise en œuvre et de son faible coût. Ce bioessai permet de quantifier les cassures de l’ADN dans les cellules d’organismes exposé(e)s à un ou plusieurs polluant(s). Après application d’une technique particulière appelée électrophorèse (champ électrique), les noyaux dont l’ADN a subi des cassures prennent une forme de comète caractéristique alors que les noyaux dont l’ADN est intact restent ronds (voir photographie ci-dessous) (Bio-tox, 2021).
Ce test peut également être utilisé comme « biomarqueur d’effets génotoxiques », notamment dans le cadre d’expérimentations in situ (ex. : encagement de moules dans une rivière).
V. SYNTHÈSE DES AVANTAGES ET DES LIMITES DES BIOESSAIS DE LABORATOIRE
| AVANTAGES | LIMITES |
| Les protocoles normalisés (pour une partie des tests) et les conditions d’exposition contrôlées permettent de comparer la toxicité de plusieurs substances/échantillons, même si les tests n’ont pas été réalisés au même moment ou par le même laboratoire | Faible réalisme environnemental en raison : -de l’utilisation d’organismes d’élevage -de l’exposition en conditions contrôlées de laboratoire qui sont très différentes des conditions de terrain |
| En cas d’exposition à un échantillon environnemental, les bioessais renseignent sur la fraction biodisponible et active du ou des contaminant(s) | Il est nécessaire de mettre en œuvre une batterie de bioessais (= plusieurs bioessais différents) afin de disposer des informations suffisantes à l’évaluation de la toxicité d’une substance ou d’un échantillon |
| L’exposition à un mélange de substances ou à un échantillon environnemental permet de prendre en compte les interactions entre contaminants (effets additifs, synergiques ou antagonistes) | En cas d’exposition à un échantillon environnemental, ils ne permettent pas à eux seuls d’identifier la ou les molécules(s) responsable(s) des effets observés |
| Certains bioessais (bioessais in vitro) permettent de décrire les mécanismes toxicologiques en jeu | Les bioessais de laboratoire ne prennent pas en compte les effets indirects des substances toxiques tels que les interactions entre espèces ou les effets trophiques (sauf dans les microcosmes) |
| Les valeurs de référence (CE50, CSEO, etc.) permettent d’établir des valeurs seuils utilisées dans la réglementation, telles que la PNEC (ex. : réglementation REACH) ou la NQE (Directive Cadre sur l’Eau) | En cas d’analyse d’échantillons environnementaux (ex. : eau de rivière), le prélèvement e le stockage des échantillons peuvent « fausser » la mobilité et la biodisponibilité des polluants présents |

Article rédigé par Vivien Lecomte, mis à jour le 6 janvier 2022 – Ecotoxicologie.fr : tous droits réservés
EN SAVOIR PLUS
–Les tests du Centre Ecotox, Centre de compétence suisse dans le domaine de l’écotoxicologie appliquée
–Package DRC (Analysis of Dose-Response Curves, R), Christian Ritz et Jens C. Strebig (University of Southern Denmark)
–MOSAIC, plateforme web de services d’analyse de données d’écotoxicité (Université Lyon 1)
-Manier N., Aït-Aïssa S. et Pandard P. (2023). Inventaire et évaluation des méthodes biologiques issues de l’écotoxicologie pour la surveillance des milieux aquatiques en vue de leur utilisation dans le cadre de la DCE. Compte-rendu des activités du groupe de travail national sur les bioessais animé par l’OFB et Aquaref. https://www.aquaref.fr/system/files/Aquaref_2021_FG1.3c1_Inventaire_evaluation_bioessais_DCE_VF.pdf
| Vous avez aimé cet article ? Faites un don d’1 € à Ecotoxicologie.fr : c’est peut-être un détail pour vous, mais pour nous ça veut dire beaucoup 🙂 |






 Il se vend près de 6 shampoings chaque seconde en France soit près de 200 millions de bouteilles par an
Il se vend près de 6 shampoings chaque seconde en France soit près de 200 millions de bouteilles par an Les produits d’entretien classiques contiennent des tensioactifs (appelés aussi agents de surface ou détergents) qui permettent d’éliminer les graisses et autres salissures à la surface de matériaux. Les détergents anioniques (charge négative) et amphotériques (dont la charge dépend du pH de l’eau) sont particulièrement présents dans les produits nettoyants, en raison de leurs propriétés nettoyantes et moussantes
Les produits d’entretien classiques contiennent des tensioactifs (appelés aussi agents de surface ou détergents) qui permettent d’éliminer les graisses et autres salissures à la surface de matériaux. Les détergents anioniques (charge négative) et amphotériques (dont la charge dépend du pH de l’eau) sont particulièrement présents dans les produits nettoyants, en raison de leurs propriétés nettoyantes et moussantes  Les phtalates, produits à quelque 6 millions de tonnes par an dans le monde
Les phtalates, produits à quelque 6 millions de tonnes par an dans le monde  20 millions de lave-linge tournent en France chaque jour en moyenne
20 millions de lave-linge tournent en France chaque jour en moyenne  La France est le 4ème consommateur mondial de médicaments : plus de 3000 médicaments à usage humain et 300 médicaments vétérinaires sont actuellement disponibles sur le marché français. Une fois que ces substances ont agi dans l’organisme, elles sont excrétées, essentiellement dans les selles et les urines, puis relarguées dans les réseaux d’eaux usées (médicaments humains) et dans les sols (médicaments vétérinaires). Une partie de ces résidus de médicaments se retrouvent donc d’une manière ou d’une autre dans le milieu aquatique. Des traces de ces composés sont d’ailleurs régulièrement détectées dans les eaux de surface et même dans les eaux de nappe
La France est le 4ème consommateur mondial de médicaments : plus de 3000 médicaments à usage humain et 300 médicaments vétérinaires sont actuellement disponibles sur le marché français. Une fois que ces substances ont agi dans l’organisme, elles sont excrétées, essentiellement dans les selles et les urines, puis relarguées dans les réseaux d’eaux usées (médicaments humains) et dans les sols (médicaments vétérinaires). Une partie de ces résidus de médicaments se retrouvent donc d’une manière ou d’une autre dans le milieu aquatique. Des traces de ces composés sont d’ailleurs régulièrement détectées dans les eaux de surface et même dans les eaux de nappe  On estime que 4000 à 6000 tonnes d’écran total sont libérées chaque année dans les zones de récifs tropicales par les 78 millions de touristes qui s’y rendent
On estime que 4000 à 6000 tonnes d’écran total sont libérées chaque année dans les zones de récifs tropicales par les 78 millions de touristes qui s’y rendent  En raison de son faible coût, l’huile de palme est, depuis quelques années, très utilisée dans l’alimentation: elle est présente dans 1 produit alimentaire empaqueté sur deux vendus en Europe (chips, biscuits, crème glacée, etc.). Or, la plantation de palmiers est à l’origine de déforestation, notamment en Indonésie. Dans ce pays, 3 millions d’hectares de forêt tropicale ont été détruits à cet effet entre 1990 et 2005 et le gouvernement prévoit un plan d’expansion des plantations de palmiers à huile de 14 millions d’hectares. La conversion des forêts en palmiers à huile a montré une perte de 80 à 100% des espèces de mammifères (dont l’orang-outan), reptiles et d’oiseaux dans ces zones
En raison de son faible coût, l’huile de palme est, depuis quelques années, très utilisée dans l’alimentation: elle est présente dans 1 produit alimentaire empaqueté sur deux vendus en Europe (chips, biscuits, crème glacée, etc.). Or, la plantation de palmiers est à l’origine de déforestation, notamment en Indonésie. Dans ce pays, 3 millions d’hectares de forêt tropicale ont été détruits à cet effet entre 1990 et 2005 et le gouvernement prévoit un plan d’expansion des plantations de palmiers à huile de 14 millions d’hectares. La conversion des forêts en palmiers à huile a montré une perte de 80 à 100% des espèces de mammifères (dont l’orang-outan), reptiles et d’oiseaux dans ces zones  Les animaux se nourrissent d’aliments (céréales, petits animaux, etc.) contenant différents polluants. Au fil du temps, ces derniers s’accumulent dans l’organisme de l’animal et en particulier dans les graisses (phénomène de bioaccumulation). Ainsi, une étude de 2010 a révélé la présence de nombreux pesticides et de PCB dans du saumon et du steak haché achetés dans des supermarchés de la région parisienne
Les animaux se nourrissent d’aliments (céréales, petits animaux, etc.) contenant différents polluants. Au fil du temps, ces derniers s’accumulent dans l’organisme de l’animal et en particulier dans les graisses (phénomène de bioaccumulation). Ainsi, une étude de 2010 a révélé la présence de nombreux pesticides et de PCB dans du saumon et du steak haché achetés dans des supermarchés de la région parisienne  Tout comme les fruits et légumes, le riz peut contenir différents polluants tels que des pesticides, en particulier s’il est issu d’une agriculture intensive classique (non « bio »). Ainsi, une étude de 2010 a révélé la présence d’isoprothiolane et de tricyclazole, 2 pesticides interdits d’usage en Europe, dans du riz acheté dans des supermarchés de la région parisienne
Tout comme les fruits et légumes, le riz peut contenir différents polluants tels que des pesticides, en particulier s’il est issu d’une agriculture intensive classique (non « bio »). Ainsi, une étude de 2010 a révélé la présence d’isoprothiolane et de tricyclazole, 2 pesticides interdits d’usage en Europe, dans du riz acheté dans des supermarchés de la région parisienne  L’eau du robinet est globalement de bonne qualité en France et les normes en vigueur sont généralement respectées
L’eau du robinet est globalement de bonne qualité en France et les normes en vigueur sont généralement respectées  Les fruits et légumes issus de l’agriculture intensive « classique » (c’est à dire non « bio ») contiennent des mélanges à faibles doses de substances chimiques classées, par les instances officielles, cancérogènes certaines, probables ou possibles ou soupçonnées d’être perturbatrices du système endocrinien. C’est ce qu’illustre notamment une étude de 2010 qui a révélé la présence de nombreux pesticides dans des produits achetés dans des supermarchés de la région parisienne
Les fruits et légumes issus de l’agriculture intensive « classique » (c’est à dire non « bio ») contiennent des mélanges à faibles doses de substances chimiques classées, par les instances officielles, cancérogènes certaines, probables ou possibles ou soupçonnées d’être perturbatrices du système endocrinien. C’est ce qu’illustre notamment une étude de 2010 qui a révélé la présence de nombreux pesticides dans des produits achetés dans des supermarchés de la région parisienne  Le lave-vaisselle est généralement moins consommateur en eau (12 L) que le lavage à la main qui dépend beaucoup du manipulateur (10 à 50 L)
Le lave-vaisselle est généralement moins consommateur en eau (12 L) que le lavage à la main qui dépend beaucoup du manipulateur (10 à 50 L)  Le liquide vaisselle est un détergent composé d’agents nettoyants appelés tensioactifs, mais aussi de colorants, conservateurs et parfums de synthèse. Bien que les tensioactifs ont l’obligation d’être biodégradables à 90%
Le liquide vaisselle est un détergent composé d’agents nettoyants appelés tensioactifs, mais aussi de colorants, conservateurs et parfums de synthèse. Bien que les tensioactifs ont l’obligation d’être biodégradables à 90%  Les composés perfluorés (PFC), tels que le téflon, ont la propriété de repousser l’eau, les matières grasses et la poussière. Ils sont ainsi utilisés comme antiadhésif dans de nombreuses poêles et casseroles. Les PFC sont persistants et s’accumulent dans les êtres vivants: certaines études ont révélé la présence de certains PFC dans les cours d’eau et les poissons (dans le foie notamment) ainsi que dans le sang humain
Les composés perfluorés (PFC), tels que le téflon, ont la propriété de repousser l’eau, les matières grasses et la poussière. Ils sont ainsi utilisés comme antiadhésif dans de nombreuses poêles et casseroles. Les PFC sont persistants et s’accumulent dans les êtres vivants: certaines études ont révélé la présence de certains PFC dans les cours d’eau et les poissons (dans le foie notamment) ainsi que dans le sang humain  3,8 millions de tonnes de bisphénol A (BPA) ont été produits en 2006
3,8 millions de tonnes de bisphénol A (BPA) ont été produits en 2006  Ces bouteilles contiennent notamment des phtalates, produits chimiques utilisés en tant que plastifiants et qui font partie de la famille des
Ces bouteilles contiennent notamment des phtalates, produits chimiques utilisés en tant que plastifiants et qui font partie de la famille des
5 commentaires
DJEDJE
J’ai beaucoup apprécié, et cela m’a fait du bien. J’avais vraiment besoin de comprendre le mécanisme de bioessais
1011-art
En lien avec votre article, dessinatrice, j’ai réalisé une série sur la pollution des océans, et donc des poissons, à partir de photographies de particules de plastiques trouvées sur des plages et des rivières aux quatre coins du monde ! Prenez le temps de découvrir ces dessins : https://1011-art.blogspot.com/p/ordre-du-monde.html
Aziza
J’ai énormément apprécié ce blog, excellent sujet
DABIRE Nibora
Merci à vous pour le travail abattu ! Il est bien structuré et clair meme pour les débutants.
Vivien Lecomte
Merci beaucoup 🙂